 |
 |
- Search
| J Environ Anal Health Toxicol > Volume 26(4); 2023 > Article |
|
ABSTRACT
The international standard (IS) currently used for determining perchlorate in soil is not applicable to trace perchlorate. We developed a quantitative analysis method using liquid chromatography-tandem mass spectrometry (LC-MS/MS) for the trace perchlorate in soil. The perchlorate was extracted from air-dried soil (<150 μm) with distilled water. We proposed the optimum extraction method that included mechanical shaking followed by centrifugation. An internal standard material (Cl18O4-) was added to the extracts and standard solutions at concentration of 5 μg L-1. The samples were analyzed by LC-MS/MS equipped with a reversed phase C18 column packed with core-shell particles containing trimethylsilane functional groups. Samples that may be interfered with organic matter present in the soil should be purified with a C18 cartridge. The method detection limit and limit of quantitation for our method was 1.31 and 4.36 μg/kg, respectively. We verified the proposed method through interlaboratory comparison test; both coefficients of variation for repeatability (CVr) and reproducibility (CVR) were less than 5%. Therefore, we concluded that the proposed method may be used for precise quantitative analysis of trace amounts of perchlorate in soil.
대표적인 oxyanion인 퍼클로레이트(ClO4-)는 Na+, K+, NH4+와 같은 양이온과 결합하여 과염소산 염(perchlorate salts)의 형태로 존재하거나 H+와 결합하여 강산인 과염소산(perchloric acid)을 형성한다. 퍼클로레이트 화합물은 건조 및 반건조 지역의 토양에서 자연적으로 발생하기도 하지만 대부분은 인위적인 활동을 통해 환경 중으로 배출된다[1]. 높은 폭발성을 가지는 퍼클로레이트 화합물은 제1·2차 세계대전 기간동안 생산량이 급증하였으며, 최근까지 환경 중 퍼클로레이트에 관한 연구들이 지속적으로 수행되고 있다[2]. 오늘날 퍼클로레이트 화합물은 로켓과 미사일의 고체 연료, 자동차 에어백의 팽창제, 윤활유, 전기도금, 고무 및 비료 제조 등 다양한 공정에서 활용되고 있으며 이런 인간 활동을 통해 군사시설, 공장, 농경지 등 다양한 환경으로 퍼클로레이트가 배출되고 있다[2,3]. 이온 전체에 전하가 균등하게 분포하고 있는 화학적 구조를 가지는 퍼클로레이트는 금속 양이온과 결합할 수 있는 능력이 매우 낮고, 착화합물을 형성하기 어려워 환경 중 퍼클로레이트 화합물은 주로 이온 형태의 퍼클로레이트를 형성한다. 또한 낮은 환원성과 토양과 같은 매질에 쉽게 흡착되지 않기 때문에 이온 형태의 퍼클로레이트는 환경에서 매우 안정적으로 존재한다[4].
환경 중에 존재하는 퍼클로레이트는 대기, 토양, 지하수, 지표수를 통해 직·간접적으로 인체에 흡수될 수 있다[5]. 특히, 토양은 퍼클로레이트의 직접적인 배출, 퍼클로레이트 오염 지하수와 지표수의 농업용수 활용을 통한 2차 오염, 또는 퍼클로레이트를 포함한 비료 사용으로 인해 오염될 수 있다. 대부분의 퍼클로레이트는 토양에 오랫동안 잔류하지 못하고, 빗물에 씻겨 지하수나 주변 지표수를 오염시키지만 일부는 식물 뿌리를 통해 흡수되어 식물 조직에 농축될 수 있다[6]. 퍼클로레이트에 오염된 식수나 음식물을 섭취하는 것은 퍼클로레이트가 인체에 흡수되는 대표적인 경로이다. 인체로 흡수된 퍼클로레이트는 갑상선의 요오드 흡수 기작에서 경쟁 반응을 통해 요오드 흡수를 방해하여 갑상선 호르몬의 생성을 저해하고, 인체의 대사반응을 교란시킬 수 있다[3, 4]. 미국 환경보호국(US EPA)은 1998년에 미국의 남서부 지역에 공급된 식수에서 퍼클로레이트가 검출된 이후에 마시는 물에 대한 오염물질 후보 목록(Contaminant Candidate List, CCL)에 퍼클로레이트를 등재하였고, 일부 주(state)는 먹는 물과 지하수의 퍼클로레이트에 대한 권고 기준을 설정하고 있으며(0.8 - 71 μg/L), EPA는 2008년에 퍼클로레이트의 먹는 물에 대한 건강 권고 농도(Interim Drinking Water Health Advisory Level)를 15 μg/L로 규정하였다[7-9]. 우리나라도 2008년에 퍼클로레이트를 수질오염물질로 지정하였고, 2010년에는 먹는 물 수질감시항목으로 등록하여 정수에 대하여 15 μg/L를 넘지 않도록 관리하고 있으며, 2019년부터 청정지역에 대한 배출 허용 기준을 0.03 mg/L 이하로 규정하고 있다[10]. 하지만 토양에 대한 퍼클로레이트의 규제 기준은 아직 구축되어 있지 않다.
일부 국가와 국제표준(ISO)은 환경 시료 중 퍼클로레이트의 정량 분석을 위한 표준 시험방법들을 제안하고 있다. US EPA는 다양한 수질 시료(예를 들어, 먹는 물, 지하수, 지표수 등) 중에 존재하는 퍼클로레이트를 정량하기 위한 시험법을 제안하고 있다. 이 시험법들은 전처리를 거친 퍼클로레이트를 전기전도도 검출기(conductivity detector) 또는 질량 분석기(mass spectrometer)를 장착한 이온크로마토그래프(ion chromatograph)로 정량하는 방법을 포함한다[11,12]. 2007년에는 수질 시료 이외에도 토양과 고형 폐기물 시료 중 퍼클로레이트를 액체크로마토그래피-탠덤 질량 분석기(LC-MS/MS) 또는 이온크로마토그래피-탠덤 질량 분석기(IC-MS/MS)를 이용하는 분석방법을 제안하였고, 추출 과정에서 퍼클로레이트의 회수율을 높일 수 있는 대체 추출방법에 대한 검증 연구들이 지속해서 수행되고 있다[13,14]. 일본에서는 수질 평가를 위한 퍼클로레이트 정량분석법을 제시하고 있는데, 고상 추출을 거친 시료를 IC-MS/MS 또는 LC-MS/MS를 이용하여 정량한다[15]. 우리나라도 2008년에 퍼클로레이트를 수질오염물질로 지정함에 따라 수질 시료 중 퍼클로레이트를 IC 또는 LC-MS를 이용하여 정량하는 수질오염공정시험기준을 수립하였다[16]. ISO는 IC를 이용하는 물과 토양 시료 중 퍼클로레이트의 표준 정량 분석법을 제시하고 있다. 특히, 2018년에 제정된 ISO 20295는 토양 중 퍼클로레이트의 표준 정량 분석법으로 토양 전처리, 시료의 정제, IC의 분석 조건 등 시험 전 과정의 최적 조건을 제시하고 있으며, 이 표준 시험 방법에 따른 정량한계는 0.1 mg/kg이다[17].
토양 중에 존재하는 퍼클로레이트의 정량 연구 결과들은 다양한 지역에서 수행되었다. 자연적으로 퍼클로레이트가 발생할 수 있는 건조 및 반건조 지역의 토양에서는 1.6~2,565 μg/kg 수준의 퍼클로레이트가 검출되었다고 보고되었다[18,19]. 퍼클로레이트의 인위적 유출 개연성이 있는 토양에서는 최고 216,000 μg/kg의 퍼클로레이트가 확인되었다[20-22]. 기존 연구들은 다양한 지역의 토양들이 ISO 20295 시험법의 정량한계(0.1 mg/kg)보다 낮은 농도의 퍼클로레이트를 포함하고 있음을 보여주었다. 또한, 연구에 적용한 추출조건, 정제 방법, 분석용 컬럼과 조건이 서로 다르기 때문에 토양 중 미량 퍼클로레이트의 정량을 위한 시험법의 표준화가 요구되고 있다.
본 연구는 LC-MS/MS를 이용하여 토양에 존재하는 미량의 퍼클로레이트를 정량하기 위한 국제표준(안)을 제안하기 위해 수행되었다. 토양 중 퍼클로레이트의 최적 추출 방법 및 조건, 그리고 기기 분석 조건을 제안하며, 정밀도, 정확도와 방법검출한계 등의 인자 도출을 통해 본 시험법의 유효성을 평가하였다.
토양 중 미량 퍼클로레이트의 정량 분석 방법에 관한 주요 국가 및 기관에서 제시하는 시험 방법과 기존에 발표된 논문의 시험 방법을 조사하였다. 기존의 토양 중 퍼클로레이트의 정량 분석 기준인 US EPA method 6850과 6860, ISO 20295 및 국내외 학술지에 게재된 논문에서 적용된 퍼클로레이트의 추출 및 분석방법을 검토하였다. 조사된 추출 및 분석 방법들을 토대로 토양 중 퍼클로레이트의 최적 시험 방법을 결정하기 위한 연구 방향을 설정하였다.
퍼클로레이트를 포함하는 공시토양을 조제하기 위한 원재료는 퍼클로레이트 오염 개연성이 없는 경기도 남양주시에 소재한 고려대학교 부속 덕소농장 부지 내 밭 토양으로 선정하였다. 토양 상부의 유기물층을 제거한 후, 10 cm 이내 깊이의 표토를 채취하였고. 채취된 토양은 풍건 후 체거름을 통해 150 μm 이하의 입자를 선별하였다. 전 처리된 토양 100 g에 1,000 μg/mL 퍼클로레이트 표준액(IC-PER-10X-1, Accustandard, USA)을 희석한 5, 10, 20, 30, 50 μg/L 퍼클로레이트 표준용액을 100 mL씩 가하고 48시간 진탕 후 50oC에서 48시간 동안 건조시켜 5, 10, 20, 30, 50 μg/kg의 공시토양을 조제하였다. 조제된 공시토양은 균질하게 혼합 후 갈색 유리병에 담아 냉장보관하였다.
토양 중 퍼클로레이트의 정량 분석의 최적 조건을 도출하기 위해 동일한 농도의 퍼클로레이트를 포함하고 있는 공시토양을 이용하여 추출 방법, 토양 시료와 추출용액 비율(이하 고액비), 정제용 C18 카트리지 적용 여부에 따라 추출 및 정제 과정을 거쳐 퍼클로레이트의 회수율을 평가하였다. 모든 처리에 따라서 3반복 실험을 수행하였다.
추출 방법에 따른 토양 중 퍼클로레이트 정량 분석 효율의 비교를 위해 10 μg/kg 퍼클로레이트 공시토양 시료를 50 mL 코니컬 튜브에 담고 증류수 30 mL를 가하였다. 기계식 진탕법(mechanical shaking), 원심분리법(centrifu-gation), 초음파추출(sonication)의 세 가지 방법을 각각 적용하여 혼합 시료로부터 퍼클로레이트를 추출하였다. 기계식 진탕법은 진폭 10 cm, 분당 100회의 속도로 5시간 동안 진탕하였고, 원심분리법은 1,800 g의 속도로 1시간 동안 원심분리 하였다. 초음파추출법은 토양과 증류수 혼합액을 초음파수조(42 kHz, 유효 HF-power 100W)에 담근 후 온도를 25oC로 유지하면서 1시간 동안 추출하였다. 각 방법으로 추출한 시료는 0.45 μm 멤브레인 필터를 통과시켜 분석용 시료로 사용하였다.
고액비에 따른 추출 효율의 비교를 위해 3, 6, 10 g의 10 μg/kg 퍼클로레이트 첨가 시료를 시험용 코니컬 튜브에 담고 증류수 30 mL을 가하여 고액비가 각각 1:10, 1:5, 1:3이 되도록 혼합하였다. 각 혼합액들을 5시간 동안 진폭 10 cm, 100 rpm의 속도로 진탕시킨 후, 1,800 g의 속도로 1시간 동안 원심분리를 통해 퍼클로레이트를 추출하였다. 추출액의 상등액을 0.45 μm 멤브레인 필터에 통과시켜 분석용 시료로 사용하였다.
30 μg/kg 퍼클로레이트 첨가 시료 10 g과 증류수 30 mL의 혼합액을 기계식 진탕기에서 분당 100회의 속도로 5시간 동안 진탕 후 1,800 g의 속도로 1시간 동안 원심분리하여 퍼클로레이트를 3반복 추출하였다. 각 추출액을 0.45 μm 멤브레인 필터를 통과시킨 후 절반씩 나누어 두 그룹으로 구분하였다. 이 중 한 그룹의 시료는 정제용 C18 카트리지(SampliQ C18 ODS, Agilent technologies, USA)를 사용한 후 분석용 시료로 사용하였고, 다른 그룹의 시료는 추가적인 정제 과정을 거치지 않고 분석용 시료로 사용하였다.
각 추출 방법과 고액비를 적용하여 추출한 시료 중 퍼클로레이트의 농도에 대해 ANOVA 분석을 실시하여 추출 방법과 고액비에 따른 분석 결과에 유의한 차이가 나타나는지를 확인하였다. 각 추출 방법과 고액비에 따른 회수율 평가 결과를 토대로 정밀도(precision)와 정확도(accuracy)를 계산하여 최적의 추출 시험법을 결정하였다. 정밀도는 평균에 대한 표준편차의 백분율인 변동계수(coefficient of variation, CV)로 계산하였고, 정확도는 표준시료 농도 대비 측정값의 비를 백분율로 나타내어 계산하였다[25]. 또한 정제용 C18 카트리지 적용 여부에 따른 분석 결과의 차이를 평가하기 위해 두 그룹 사이의 대응 표본 t-test를 수행하였다. 모든 통계 분석은 R 프로그램(버전 4.2.2)을 이용하여 수행하였다.
1000 μg/mL 퍼클로레이트 표준액(IC-PER-10X-1, Accustandard, USA)을 이용하여 조제한 검정곡선용 표준용액과 퍼클로레이트 추출 시료 10 mL에 1 mg/L 내부표준물질(NaCl18O4, DionexTM Perchlorate-ISTD, Thermo-Fisher Scientific, USA) 50 μL를 첨가하여 표준용액과 시료 중 Cl18O4-의 농도를 5.0 μg/L로 조제하였다.
삼중 사중극자(triple-quadrupole) 탠덤질량분석기(API3200, AB SCIEX, USA)를 장착한 고성능액체크로마토그래프(HPLC) 기기(Agilent 1200 series, Agilent, USA)를 이용하여 시료 중 퍼클로레이트를 정량 분석하였다. 분석용 컬럼은 소수성 물질 분리에 범용적으로 활용되는 Phenomenex Kinetex-C18(2.1 × 100 mm, 2.6 μm)를 이용하였으며, 보호 컬럼으로 Phenomenex Security-Guard ULTRA C18 cartridge(2.1 × 2 mm)를 이용하였다. 선택한 컬럼의 성능 분석을 위해 퍼클로레이트 분석 전용 컬럼인 KP-RPPX (4.6 × 250 mm, 5.0 μm)를 이용한 정량 분석 결과와 t-test 분석을 통해 분석 능력을 비교하였다. 통계 분석은 R 프로그램(버전 4.2.2)을 이용하여 수행하였다. HPLC 분석을 위한 시료 주입량은 10 μL, 컬럼 오븐 온도는 35oC로 설정하였다. 0.1% 아세트산을 포함한 아세토나이트릴(ACN, 용리액 A)과 0.1% 아세트산수용액(용리액 B)을 1:1의 비율로 0.2 mL/min의 유속으로 흘려주었다.
질량 분석기의 이온화 방식은 음이온 모드의 전자분무 이온화방법(electrospray ionization, ESI), 분무 전압은 - 4.5 kV, Collision gas (N2) 온도는 400oC로 설정하였고, 다중 반응 모니터링(multiple reaction monitoring, MRM) 모드를 적용하여 퍼클로레이트와 내부표준물질을 검출하였다. 퍼클로레이트와 내부표준물질의 크로마토그램과 기기 조건은 Fig. 1과 같다. 정량에 활용된 전구체 이온 (precursor ion)과 생성물 이온(product ion)의 질량 전하비(m/z) 및 상세 조건은 Table 1에 나타내었다.
5, 10, 20 μg/kg 퍼클로레이트 토양 시료에 대하여 본 연구에서 제안된 최적 추출 및 기기 분석법을 적용하여 8반복 실험을 수행하였다. 제안된 정량 분석 기술의 유효성을 검증하기 위해 분석 결과에 대하여 정량인자(방법검출한계(MDL), 정량한계(LOQ), 정밀도(precision), 정확도(accuracy))를 평가하였다. MDL과 LOQ는 8반복 실험 결과의 표준편차에 각각 2.998 (t7, 0.99)과 10을 곱하여 계산하였다[25].
본 연구에서 제안된 토양 중 퍼클로레이트 정량 분석 기술의 반복성 및 재현성의 유효성 여부를 평가하기 위해 국내·외 8개 실험실을 대상으로 실험실간 비교 시험을 수행하였다. 서울대학교 농생명과학공동기기원(NICEM)으로부터 제공받은 퍼클로레이트 오염 토양 시료(PC-1과 PC-2)를 참가 실험실에 50 g씩 배포 후 각 실험실에서 수행된 퍼클로레이트 정량 분석 결과를 취합했다. 분석 결과들은 ISO 5725-2에 따라 이상치를 검정하고, 평균과 재현성 및 반복성의 표준편차와 변동계수를 도출하였다[26].
토양 중 퍼클로레이트를 정량 분석하기 위해서는 토양 시료로부터 퍼클로레이트를 충분히 추출하는 과정이 선행되어야 한다. US EPA method 6850, 6860과 ISO 20295, 그리고 토양을 포함하는 고형 환경시료 중 퍼클로레이트 정량 분석을 수행한 대부분의 문헌에서는 퍼클로레이트를 추출하기 위한 용매로 증류수를 사용하였다. 최 등(2015)에 따르면 퍼클로레이트는 일반적으로 음전하를 가지는 토양에 약하게 흡착되어 있기 때문에, 증류수를 가한 후 물리적인 교반만으로도 토양 중 총 퍼클로레이트의 추출이 가능하다[10].
US EPA method와 ISO 20295를 포함한 기존의 토양 시료 중 퍼클로레이트 정량 연구 논문들을 검토한 결과 토양 중 퍼클로레이트의 추출방법과 고액비는 다양하게 적용되어 왔다(Table 2). 퍼클로레이트 추출 방법으로는 기계식 진탕법(mechanical shaking), 원심분리법(centrifu-gation), 초음파 추출법(sonication)이 주로 적용되었다. Kounaves et al. (2010)과 Ye et al. (2013)은 증류수를 가한 토양 시료를 30초 간 가볍게 혼합한 후에 실온에서 23시간 동안 채취한 용출수(leachate) 중 퍼클로레이트를 분석하였다[19,21]. 최 등(2015)과 ISO (2018)은 추출 방법에 따른 퍼클로레이트 회수율 평가를 통해 기계식 진탕법(mechanical shaking), 원심분리법(centrifugation), 초음파추출법(sonication)의 추출 효율을 비교하였다. 세 가지 추출 방법 모두 2% 이내에 상대표준편차(RSD)를 보여 정밀도에서는 적합한 것으로 판정되었으나, 각 추출방법의 정확도는 86%, 85%, 69%로 sonication의 정확도는 토양오염공정기준의 기준치인 70%에 미달하는 것으로 나타났다[10,17]. US EPA method 6850과 6860은 sonication 에서 85% 이상의 회수율이 보고된 sonication 추출 방법의 정확도가 기준치보다 낮게 평가된 이유는 사용한 초음파 추출 장치가 원추형 장비가 아닌 수욕조형 장비이기 때문인 것으로 사료된다[10]. ISO (2018)은 mechanical shaking과 centrifugation를 혼합한 추출 방법의 정밀도와 정확도가 0.15%와 100.31%로 평가되어 최적의 추출 방법으로 이 혼합 추출 방법을 제안하였다[17]. 이외에도 많은 연구자들이 토양 중 퍼클로레이트의 추출 방법으로 mechanical shaking과 centrifugation을 혼합하여 적용한 것으로 조사되었다[18,20,22,24].
토양 시료와 추출용액 사이의 고액비는 1:2.3~1:10까지 매우 다양하게 적용되었다. Gan et al. (2014)은 96개의 토양 시료에 대하여 1:10의 고액비로 추출한 반면 상대적으로 낮은 퍼클로레이트 농도를 가지는 2개의 토양 시료는 1:4의 고액비를 적용하였다[22]. 최 등(2015)은 고액비에 따른 퍼클로레이트의 회수율 평가를 수행하였고, 1:2, 1:3, 1:5 조건의 정밀도와 정확도는 각각 0.43%, 0.82%, 3.18%와 100.25%, 90.13%, 70.63%로 나타나 모든 고액비 조건이 토양오염공정기준의 기준치를 만족하는 것으로 평가되었다. 다만, 1:10의 고액비 조건에서는 시료 중 퍼클로레이트가 지나치게 희석되어 검출되지 않는 것으로 나타났다. 1:5 조건의 정확도가 상대적으로 낮은 이유 역시 희석의 영향으로 상대적으로 추출액의 농도가 낮아졌기 때문인 것으로 판단되었다[10]. 추출 과정에서 고액비는 시료 중 퍼클로레이트의 대략적인 농도 범위를 고려하여 결정되어야 할 필요성이 있다.
대부분의 연구들은 추출 시료를 0.2~0.45 μm 필터를 통과하여 분석용 시료로 사용하였다. 분석 시료의 정제를 위하여 테플론[13,14], hydrophilic polypropylen0[17], poly-ethersulfone[17, 18], cellulose acetate[17,24], 나일론[20] 등 다양한 재질의 필터가 사용되었다. 정제용 필터의 재질은 퍼클로레이트 정량 분석에 유의한 영향을 끼치지 않는 것으로 사료되며, 분석 토양의 특성에 따라 적절한 재질의 필터를 선택할 수 있다. ISO 20295를 포함한 일부 연구에서는 토양에 함유된 음이온(예를 들어, 염소이온(Cl-), 황산이온(SO42-), 탄산이온(CO32-)에 의한 간섭을 최소화하기 위해 Ag, Ba, H, Na 카트리지를 사용하였으며[17,24], US EPA method 6850과 6860은 과량의 유기물을 포함하고 있는 토양 추출 시료를 C18 카트리지에 통과시켜 유기물을 제거한 후 정량하는 방법을 제안하고 있다[13,14]. 분석 토양에 대한 화학성 분석을 통해 음이온 또는 유기물에 의한 간섭이 발생할 수 있을 것으로 판단될 때 정제용 카트리지를 이용하여 시료 중 간섭 물질의 제거 과정이 수행되어야 할 필요가 있다.
본 연구에서는 토양 중 존재하는 미량의 퍼클로레이트를 추출할 수 있는 최적 방법과 고액비를 제안하기 위한 mechanical shaking, centrifugation, sonication의 추출 효율과 1:3, 1:5, 1:10의 고액비에 따른 퍼클로레이트의 회수율 평가를 수행하였다.
이온크로마토그래피(IC)와 액체크로마토그래피(LC)가 퍼클로레이트 정량을 위한 분석 기기로 주로 활용되고 있다. ISO 20295는 토양 중 퍼클로레이트 정량을 위한 분석 방법으로 이온크로마토그래피-전기전도도 검출법(IC-CD)을 적용하는 표준 분석 방법을 제공하고 있다. EPA method 6850과 6860은 각각 액체크로마토그래피-전자분무이온화-질량분석법(LC-ESI-MS)과 이온크로마토그래피-전자분무이온화-질량분석법(IC-ESI-MS)을 적용하는 표준 시험방법이다. IC는 LC의 한 종류이며, 시료 중 다양한 이온들의 교환 특성을 기반으로 혼합 시료 중 이온을 분리하는 방법이다[37]. 본 연구에서 검토한 기존 연구 사례들에 적용된 퍼클로레이트 분리 방법과 검출 방법을 토대로 분석 조건을 고찰하였다.
이온교환(ion exchange) 컬럼을 적용한 IC와 LC에는 용리액으로 KOH[10,13,14,19,21], NH4OH, NH4HCO3, CH3CO2NH4[13,14], (NH4)2CO3[14], NaOH[17,18], NaHCO3, Na2CO3[14,17]와 CH3NH2[13,14] 등의 용액에 필요에 따라 유기용매(예를 들어, CH3CN) 첨가와 pH를 조절한 용액을 사용하였다. 역상(reversed-phase) 컬럼을 적용한 LC 분석을 위한 용리액으로는 CH3CN[13], HCOOH[20,22,24]와 CH3OH[22,24] 용액이 사용되었으며, 필요에 따라 CH3COOH 용액 등을 소량 첨가하여 용리액의 pH를 조절하였다. 퍼클로레이트의 수화 에너지(hydration energy, ΔGh)는 - 205 kJ/mol로 퍼클로레이트는 토양 주요 음이온인 HCO3- (-335 kJ/mol), Cl- (-340 kJ/mol), CO32- (-1,315 kJ/mol), SO42- (-1,295 kJ/mol)들에 비하여 상대적으로 높은 소수성을 가진다[28]. 이와 같은 특성 때문에 대표적인 역상 컬럼인 C18 (octadecyl siloxane) 컬럼은 퍼클로레이트에 대하여 높은 선택성을 가지므로[29] 음이온의 동시 용출(co-elution)에 의한 간섭을 최소화할 수 있다.
분리된 퍼클로레이트의 정량에 적용되는 검출법은 전기전도도 검출법(Conductivity cell detection, CD)과 탠덤질량분석법(Tandem mass spectrometry, MS/MS)이 주로 활용되고 있다. IC-CD는 다양한 시료 중 퍼클로레이트를 정량하기 위해 가장 흔히 활용되는 검출방법으로 이온크로마토그래피로 분리된 이온에 의한 전류를 측정하여 분리된 이온의 농도를 정량하는 방법이다. 이 방법은 US EPA에서 제안한 먹는 물 시료 중 퍼클로레이트의 정량 방법에 처음 적용된 분석 방법이다[30]. 하지만 고농도의 이온들을 포함하고 있는 시료 중 퍼클로레이트 정량에 IC-CD법을 적용할 경우 시료 중 불순물에 의한 배경 신호의 증가와 다른 이온에 의한 간섭 현상으로 인해 퍼클로레이트의 농도가 과대평가되거나 검출한계 미만의 퍼클로레이트를 포함하고 있는 시료에서도 위양성 (false positive)의 결과가 나타날 수 있다[31,32]. 탠덤질량분석법은 미량으로 존재하는 퍼클로레이트의 정확한 정량분석을 위해 활용되는 검출방법이다. IC와 LC에 공통적으로 적용될 수 있으며, 크로마토그래피에 의해 분리된 퍼클로레이트 이온은 음이온 모드의 전자분무이온화(electrospray ionization, ESI)를 통해 탠덤질량분석기로 도입되어 다중반응 모니터링(multiple reaction monitoring, MRM) 모드로 분석된다[29]. 탠덤질량분석기를 이용한 환경 시료 중 퍼클로레이트 정량은 여러 국가에서 공인된 분석방법으로 활용되고 있다. 미국의 US EPA는 탠덤질량분석기를 이용한 토양과 물 시료 중 퍼클로레이트 정량 방법을 제시하고 있으며[11-14], 한국과 일본은 LC-MS/MS를 이용한 수질 퍼클로레이트 정량 방법을 규정하고 있다[15,16]. 유럽연합(EU)은 LC-MS/MS를 이용한 식품 중 퍼클로레이트를 정량하는 위원회 권고안(commission recommendation) 을 제정하였다[32].
검토된 퍼클로레이트 정량 분석 방법을 토대로 퍼클로레이트 추출방법과 조건에 대한 비교시험을 통해 최적 시험법을 제안하였다.
10 μg/kg 퍼클로레이트 토양 시료를 기계식 진탕법(mechanical shaking), 원심분리법(centrifugation), 초음파추출법(sonication)으로 각각 추출하여 회수율 평가를 실시하였다(Table 3). 모든 분석방법에 대하여 3반복 평가를 실시하였으며, 정량된 평균 농도는 각각 10.96 μg/kg, 8.14 μg/kg, 8.11 μg/kg으로 평가되었다. 반복 실험 결과에 대한 정밀도(precision)와 정확도(accuracy)를 토대로 각 추출 방법에 대한 유효성을 평가하였다. 기계식 진탕법, 원심분리법, 초음파추출법의 정밀도는 각각 28.7%, 8.29%, 5.88%로 계산되었으며, 정확도는 각각 109.6%, 81.4%, 81.1%로 계산되었다. 토양오염공정시험기준은 분석 결과에 대한 정밀도와 정확도가 각각 30% 이내와 70%~130%의 범위에 해당하여야 하는 것으로 규정하고 있다. 본 연구에서 수행된 회수율 평가 결과는 모든 추출 방법이 해당 기준을 충족하는 것으로 나타났다. 분산분석법(ANOVA)을 통해 95% 신뢰수준에서 추출 방법에 따른 퍼클로레이트 정량 농도의 유의한 차이는 없는 것으 로 평가되었다(F value = 2.28, 유의확률 = 0.1834). Table 3에서 기계식 진탕법으로 추출된 퍼클로레이트의 분석 결과가 실제 첨가된 퍼클로레이트 농도와 가장 근사하였지만, 정밀도는 28.7%로 다른 방법에 비하여 상대적으로 높게 나타났다. 또한, 기계식 진탕 이후 0.45 μm 필터를 이용하여 정제할 때 필터가 쉽게 막히는 어려움이 있었다. 따라서 본 연구에서는 기계식 진탕 이후 원심분리를 통해 정제를 쉽게 하는 방법을 제시하였다.
10 μg/kg 퍼클로레이트 토양 시료를 1:3, 1:5, 1:10의 고액비로 추출하여 회수율 평가를 실시하였다(Table 4). 각 고액비에 대하여 정량된 평균 농도는 11.81 μg/kg, 10.68 μg/kg, 8.88 μg/kg으로 평가되었다. 1:3, 1:5, 1:10의 고액비에 따른 정밀도는 각각 5.11%, 5.81%, 5.19%로 계산되었으며, 정확도는 각각 118.1%, 106.8%, 88.8%로 계산되었다. 정밀도와 정확도를 기반으로 추출 고액비에 대한 유효성은 토양오염공정시험에서 제시하고 있는 기준(정밀도 30% 이내와 정확도 70%~130%)을 충족하는 것으로 나타났다. 하지만 고액비에 따른 퍼클로레이트 정량의 분산분석(ANOVA) 결과는 95% 신뢰도에서 처리 사이에 유의한 차이가 있는 것으로 확인되었다(F value = 20.43, 유의확률 = 0.0021). 분산분석 결과 1:10의 고액비 조건에서 다른 처리구들과 다르게 유의한 차이가 나타난 것은 추출용액의 비율이 높아 시료 중 퍼클로레이트가 다른 처리구에 비해 더 희석되었기 때문으로 판단되었다. IC-CD를 이용한 토양 중 퍼클로레이트 정량 연구에서도 1:2, 1:3, 1:5의 고액비로 퍼클로레이트를 정량한 결과 추출액의 부피가 증가할수록 평균 농도가 감소하였으며, 1:10 고액비에서는 시료 중 퍼클로레이트가 검출되지 않는 결과를 보였다[10]. 위 연구 결과들은 1:3과 1:5의 고액비 조건 모두가 토양 중 퍼클로레이트 추출에 적합한 비율임을 보여주었다. 또한 Table 2를 통해서도 많은 연구 사례에서 1:3 또는 1:5의 고액비가 적용된 것을 확인할 수 있다. 본 연구의 목표가 토양 중에 미량으로 존재하는 퍼클로레이트의 정량 기술의 표준화에 있으므로, 분석에 사용되는 용매 양을 낮추어 퍼클로레이트 희석에 따른 영향을 최소화하기 위해 본 연구에서 평가한 고액비 중 가장 낮은 비율인 1:3의 고액비를 선택하여 퍼클로레이트 정량 분석법을 평가하였다. 또한, 분석에 사용되는 증류수의 양과 분석에서 발생하는 폐액의 양을 줄이기 위해 통계적으로 유의한 차이가 없는 고액비 조건 중 낮은 1:3의 고액비를 적용하였다.
정제용 C18 카트리지 사용 여부에 따른 퍼클로레이트의 정량 효율을 평가하기 위해 동일한 추출액을 두 그룹으로 구분하여 정량분석을 수행하고, 분석 결과에 대하여 대응 표본 t-test를 수행하였다. C18 카트리지 사용에 따라 평가된 농도 차이의 평균은 1.58 μg/kg, 표준편차는 0.96 μg/kg로 계산되었으며, 이는 95% 유의수준에서 두 그룹 사이의 분석 결과에 유의한 차이가 없는 것으로 나타났다(t value = 2.87, 유의확률 = 0.1033). C18 카트리지 적용 전과 후의 크로마토그램을 비교한 결과 퍼클로레이트 피크 주변 노이즈의 감소가 확인되었다(Figure 2). 본 연구에 사용된 퍼클로레이트 표준 토양 시료 중 유기물 함량은 2.54%로 국내 논과 밭 토양의 평균 유기물 함량과 유사한 수준이었다[35]. 국내의 일반적인 농경지 토양과 유사한 수준의 유기물을 포함하는 토양 시료의 경우 C18 카트리지를 이용한 추가 정제 과정이 반드시 수행될 필요는 없을 것으로 판단되었다. 하지만 토양 중 유기물에 의한 간섭 영향이 의심된다면 C18 카트리지를 이용한 시료 정제가 수행되어야 한다.
50 μg/kg 퍼클로레이트 시료 추출액을 Kinetex-C18와 KP-RPPX 컬럼을 이용하여 7반복 분석을 수행한 결과는 Table 5와 같다. 각각의 컬럼을 이용하여 분석된 퍼클로레이트의 정량 결과에 대한 t-test 결과는 95% 신뢰수준에서 컬럼 종류가 분석 결과에 유의한 영향을 끼치지 않았음을 보여주었다 (t value = 0.08, 유의확률 = 0.9396). Kinetex-C18와 KP-RPPX 컬럼으로 정량된 퍼클로레이트의 정밀도는 각각 13.4%와 3.5%이고 정확도는 각각 103.8%와 103.4%로 계산되었으며, 토양오염공정시험기준 상의 정밀도와 정확도 규정범위를 모두 만족하는 것으로 평가되었다. 이를 통해 범용적으로 사용되는 C18 역상 컬럼은 퍼클로레이트 정량에 특화된 KP-RPPX 컬럼과 동등한 분석 성능을 가지는 것으로 판단되었다.
앞에서 언급한 바와 같이 퍼클로레이트 정량을 위한 LC-MS/MS에는 이온교환 컬럼과 역상 컬럼이 모두 적용될 수 있다. 이온교환 컬럼을 적용할 때는 potassium, sodium, ammonium 등을 포함하는 이온성 용액을 용리액으로 사용한다. 이온교환 컬럼에 의해 분리된 시료 중 퍼클로레이트를 질량 검출기로 분석하기 위해서는 용리액 중 비휘발성 이온의 제거가 필요하며, 용리액에 의한 LC-MS/MS 기기의 오염이 발생할 수 있다.
본 연구에서 사용한 C18 역상 컬럼은 trimethylsilane기(-Si(CH2)8)와 결합된 octadecyl (C18H37) 체인 구조를 가지는 100 Å의 입자들로 구성된 고정상을 가지는 컬럼이다. KP-RPPX 컬럼은 organo-silane ligand를 형성할 수 있는 초고밀도의 고정상을 가지고 있는 컬럼이다. 두 컬럼 모두 용리액으로 ACN과 같은 유기 용매를 포함하는 용액을 사용한다. 50% ACN의 용리액에서 컬럼의 고정상은 시료 중 유기 물질들을 고정하지 못하기 때문에 시 료 중 유기 물질로부터 퍼클로레이트를 분리할 수 있다. 또한, 퍼클로레이트는 시료 중에 존재하는 다른 음이온에 비하여 높은 소수성을 갖기 때문에 선택적으로 분리될 수 있어 이온교환 컬럼에서 발생할 수 있는 다른 이온에 의한 간섭을 최소화할 수 있다. 이외에도 역상 컬럼을 이용한 분석은 이온교환 컬럼보다 빠른 퍼클로레이트의 분리가 가능하고, 질량분석을 위한 높은 이온화 효율을 가지며 기기의 오염을 최소화할 수 있다는 장점을 가진다[29,31]
본 연구를 통해 제안된 토양 시료 중 퍼클로레이트의 정량 분석법을 적용하여 퍼클로레이트의 정량 인자를 평가하였다. 5, 10, 20 μg/kg 농도의 퍼클로레이트 토양 시료 10 g과 증류수 30 mL를 혼합하여 5시간동안 기계식 진탕 후 1시간 동안 1800 g의 속도로 원심분리하여 퍼클로레이트를 추출하였다. 0.45 μm 필터를 이용하여 정제 된 추출 시료를 LC-MS/MS로 분석하였다. 각 시료에 대하여 8반복 수행한 결과는 Table 6과 같다. 8반복 실험 결과의 정밀도와 정확도는 각각 3~10%와 90~120%의 범위에 해당하며, 방법검출한계(method detection limit, MDL)와 정량한계(limit of quantitation, LOQ)는 각각 1.31 μg/kg와 4.36 μg/kg로 계산되었다. IC를 이용한 토양 중 퍼클로레이트 정량방법의 국제표준인 ISO 20295에 따르면 기존 분석방법의 검출한계는 0.1 mg/kg이다[17]. 국내 수질오염공정시험기준은 수질 시료 중 퍼클로레이트는 IC와 사중극자형 질량분석기를 장착한 LC-MS로 분석할 수 있으며, 두 시험법의 정량한계는 모두 2 μg/L로 보고되었다[16]. 본 연구에 적용된 고액비(1:3)를 고려할 때, 추출액 중 퍼클로레이트 농도의 정량한계는 약 1.45 μg/L로 수질오염공정시험기준의 분석방법과 비교하여 동등한 성능을 갖는 것으로 판단되었다. 본 연구에서 제안하는 분석방법은 기존 분석방법에서 검출될 수 없었던 미량 퍼클로레이트를 검출할 수 있는 장점을 갖는다.
두 가지 농도의 퍼클로레이트 토양 시료(PC-1과 PC-2)에 대하여 국내·외 8개의 실험실에서 동일한 추출 및 분석방법을 적용하여 퍼클로레이트의 정량 분석을 수행하였다. 8개 실험실에서 측정된 퍼클로레이트 농도의 산점도는 Fig. 3과 같다. 분석된 실험 결과들에 대한 이상치를 평가하기 위해 코크란 검정(Cochran test)과 그럽스 검정(Grubbs test)을 각각 시행하였다. PC-1 시료에 대한 코크란 통계량(0.728)은 1% 기각치(0.615)를 초과하였으며, 한 개 실험실의 결과가 이상치로 판정되었다. PC-2 시료에서는 모든 참가 실험실의 결과 중에 이상치가 확인되지 않았다. PC-1 시료와 PC-2 시료에 대한 실험실간 비교 시험의 통계 분석 결과는 Table 7과 같다. 이상치를 제외한 PC-1 시료의 평균 농도는 27.15 μg/kg로 측정되었고, 정확도는 108.6%로 평가되었다. 실험실 간 재현-변동계수(CVR)와 실험실 내 반복-변동계수(CVr)는 각각 3.11%와 0.98%로 도출되었다. PC-2 시료의 평균 농도는 57.87 μg/kg로 측정되었고, 정확도는 96.45%였다. 실험실 간 재현-변동계수(CVR)와 실험실 내 반복-변동계수(CVr)는 각각 4.09%와 1.07%로 도출되었다. 두 시료에서 모든 변동계수가 5% 이내로 도출되었으며, 이를 통해 본 연구를 통해 제안된 시험법이 높은 재현성과 반복성을 보이는 유의한 분석방법임을 확인하였다.
토양 중 퍼클로레이트 정량을 위한 기존 국제표준은 0.1 mg/kg 미만으로 존재하는 미량 퍼클로레이트를 검출하지 못하는 한계를 가지고 있다. 본 연구는 토양 및 수질에서의 미량 퍼클로레이트 분석과 관련된 기존 문헌 조사를 통해 액체크로마토그래피-탠덤질량분석법(LC-MS/MS)을 적용한 퍼클로레이트의 정량 분석법을 개발하였다. 퍼클로레이트의 회수율 평가를 통해 0.15 mm 이하의 풍건 토양과 증류수 혼탁액(고액비 1:3)을 기계식 진탕 후 원심 분리를 통해 추출하는 방법을 최적 추출 방법으로 제안하였다. 만약 고농도의 유기탄소를 포함하고 있는 토양의 경우 C18 카트리지를 선택적으로 적용하여 유기물에 의한 간섭을 최소화한다. 시료로부터 퍼클로레이트를 분리하기 위해 trimethylsilane 기를 가지고 있는 고정상으로 충진된 역상 HPLC 컬럼을 사용하며, 용리액으로는 1% 의 아세트산을 포함하는 50% ACN 용액을 사용한다. 본 연구에서 제안된 분석 방법의 방법검출한계(MDL)는 1.31 μg/kg, 정량한계(LOQ)는 4.36 μg/kg로 계산되었으며, 실험실간 비교시험을 통해 재현-변동계수(CVR)와 반복-변동계수(CVr)는 모두 5% 이내로 평가되었다. 본 연구에서 제안된 퍼클로레이트 정량 방법을 농경지 및 군사시설 인근 토양 중 퍼클로레이트 오염 조사에 활용할 것을 제안한다.
Fig. 1.
Chromatogram and analysis conditions of LC-MS/MS for determination of (a) perchlorate (ClO4-) and (b) internal standard (Cl18O4-). The table in the figure showed the analysis conditions for determining the ClO4- ion. ClO4- and Cl18O4- were determined at 1.820 and 1.815 min, respectively.
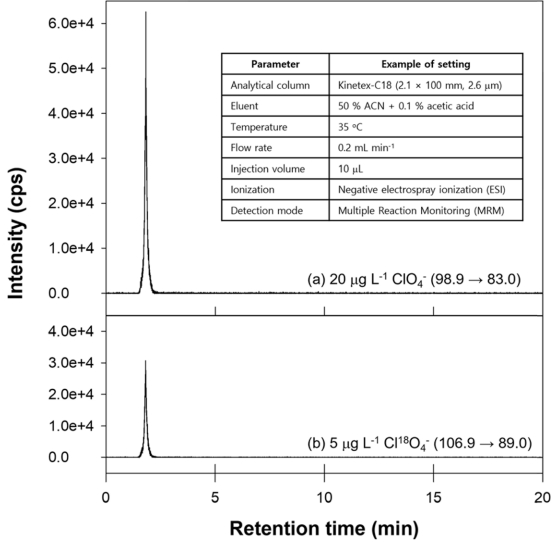
Fig. 2.
Comparison of chromatograms of LC-MS/MS for determination of perchlorate (ClO4-). Black line shows a chromatogram of perchlorate without cleanup, and gray line shows a chromatogram of perchlorate filtered using C18 cartridge.

Fig. 3.
Scatter plots of determined perchlorate concentration for (a) PC-1 and (b) PC-2 in the interlaboratory comparison study. The red dashed lines represent the average concentrations of the perchlorate in each sample measured in the interlaboratory comparison test.

Table 1.
Multiple reaction monitoring conditions for determination of perchlorate
Table 2.
Extraction method, solid-solution ratio (SSR), and analysis instrument for determination of perchlorate in soil applied in the previous studies
| Author (year) | Extraction method | SSR | Analysis instrument (Separation principle) | Concentration | Ref |
|---|---|---|---|---|---|
| Rao et al. (2007) | Shaking + centrifugation | 1:3 | IC-MS/MS (Ion exchange) | 1.6~13 µg kg-1 | [18] |
| US EPA (2007) | Sonication | 1:10 | LC-MS/MS (Ion exchange or Reversed phase separation) | 16.0~564 µg kg-1 | [13] |
| US EPA (2007) | Sonication | 1:10 | IC-MS/MS (Ion exchange) | 16.0~564 µg kg-1 | [14] |
| 김 등 (2008) | Shaking + centrifugation | 1:3 | LC-MS/MS (Reversed phase separation) | 0.70~18.24 µg kg-1 | [20] |
| 김 등 (2008) | Centrifugation | 1:2.3 | LC-MS (Reversed phase separation) | 0.077~0.441 µg kg-1 | [24] |
| Kounaves et al. (2010) | Leaching | 1:5 | IC-CD (Ion exchange) | 31~630 µg kg-1 | [19] |
| Ye et al. (2013) | Leaching | 1:5 | IC-MS (Ion exchange) | 2.15~7.02 µg kg-1 | [21] |
| Gan et al. (2014) | Shaking + centrifugation | 1:4~1:10 | LC-MS/MS (Reversed phase separation) | 0.001~216 mg kg-1 | [22] |
| 최 등 (2015) | Shaking + centrifugation | 1:3 | IC-CD (Ion exchange) | 0.4~2 mg kg-1 | [10] |
| ISO (2018) | Shaking + centrifugation | 1:3 | IC-CD (Ion exchange) | 1.34~4.58 mg kg-1 | [17] |
| Calderon et al. (2020) | Centrifugation | 1:10 | LC-MS/MS (Ion exchange) | 22.4 µg kg-1 | [23] |
Table 3.
Quantitative results of perchlorate by the extraction method
Table 4.
Quantitative results of perchlorate by the solid-solution ratio (SSR)
Table 5.
Comparison of quantitative results of perchlorate in soil using each reversed-phase column, Kinete-C18 and KPRPPX column
Table 6.
Factors for quality assurance and quality control (QA/QC) for the determination of perchlorate in soil
Table 7.
Statistical table of results of the interlaboratory comparison study to verify the proposed method for quantitative analysis of perchlorate in soil.
| Sample | l a) | n b) | nA c) | nAP d) | x e) | SR f) | CVR g) | Sr h) | CVr i) |
|---|---|---|---|---|---|---|---|---|---|
| PC-1 | 7 | 21 | 3 | 12.5 | 27.15 | 0.84 | 3.11 | 0.27 | 0.98 |
| PC-2 | 8 | 24 | - | - | 57.87 | 2.37 | 4.09 | 0.62 | 1.07 |
참고문헌
1. P. K. Dasgupta, P. K. Martinelango, W. A. Jackson, T. A. Anderson, K. Tian, R. W. Tock, and S. Rajagopalan, “The origin of naturally occurring perchlorate: The role of atmospheric processes”, Environmental Science and Technology, 2005, 39, 1569-1575.


2. R. Dalpozzo, G. Bartoli, L. Sambri, and P. Melchiorre, “Perchloric acid and its salts: Very powerful catalysts in organic chemistry”, Chemical Reviews, 2010, 110 (6), 3501-3551.


3. J. J. J. Clark, Toxicology of perchlorate, 2000, 15-30. Springer New York, US.
4. E. T. Urbansky, “Perchlorate as an environmental contaminant”, Environmental Science and Pollution Research, 2002, 9 (3), 187-192.


5. 남국 허, 여민 윤, and 진욱 정, “퍼클로레이트: 먹는 물 산업 관련 리뷰”, 지반환경, 2007, 8 (1), 57-62.
6. J. J. Ellington, N. L. Wolfe, A. W. Garrison, J. J. Evans, J. K. Avants, and Q. Teng, “Determination of perchlorate in tobacco plants and tobacco products”, Environmental Science and Technology, 2001, 35, 3213-3218.


7. US Environmental protection agency, Announcement of the drinking water contaminant candidate list, 1998.
8. US Environmental protection agency, Interim drinking water health advisory for perchlorate, 2008.
9. US Environmental protection agency, Technical fact sheer - Perchlorate, 2017.
10. 천일 최, 군택 이, 민기 박, 문주 정, 지양 김, 지영 강, and 지영 류, “이온크로마토그래피를 이용한 토양 중 퍼클로레이트 정량에 관한 국제표준(안) 연구”, 토양지하수환경학회지, 2015, 20 (6), 55-61.
11. US Environmental protection agency, Method 331.0 Determination of perchlorate in drinking water by liquid chromatography electrospray ionization mass spectrometry, 2005.
12. US Environmental protection agency, Method 332.0 Determination of perchlorate in drinking water by ion chromatography with suppressed conductivity and electrospray ionization mass spectrometry, 2005.
13. US Environmental protection agency, Method 6850 Perchlorate in water, soils and solid wastes using high performance liquid chromatography/electrospray ionization/mass spectrometry (HPLC/ESI/MS or HPLC/ESI/MS/MS), 2007.
14. US Environmental protection agency, Method 6860 Perchlorate in water, soils and solid wastes using ion chromatography/electrospray ionization/mass spectrometry (IC/ESI/MS or IC/ESI/MS/MS), 2007.
15. 일본 환경성, 요 조사 항목 및 조사 매뉴얼 (수질, 저질, 수생생물), 2008.
16. 환경부, 수질오염공정시험기준, 2011.
17. ISO 20295:2018, "Soil quality - Determination of perchlorate in soil using ion chromatography", 2018
18. B. Rao, T. A. Anderson, G. J. Orris, K. A. Rainwater, S. Rajagopalan, R. M. Sandvig, B. R. Scanlon, D. A. Stonestrom, M. A. Walvoord, and W. A. Jackson, “Widespread natural perchlorate in unsaturated zones of the Southwest United States”, Environmental Science and Technology, 2007, 41, 4522-4528.


19. S. P. Kounaves, S. T. Stroble, R. M. Anderson, Q. Moore, D. C. Catling, S. Douglas, C. P. Mckay, D. W. Ming, P. H. Smith, L. K. Tamppari, and A. P. Zent, “Discovery of natural perchlorate in the Antarctic dry valleys and its global implications”, Environmental Science and Technology, 2010, 44, 2360-2364.


20. 민영 김, 원진 심, 응선 이, and 정은 오, “LC/MS/MS를 이용 한 하천, 토양 및 유제품 중 퍼클로레이트 분석”, 한국환경분석학회지, 2008, 11 (4), 254-260.
21. L. Ye, H. You, J. Yao, X. Kang, and L. Tang, “Seasonal variation and factors influencing perchlorate in water, snow, soil and corns in Northeastern China”, Chemosphere, 2013, 90, 2493-2498.


22. Z. Gan, H. Sun, R. Wang, and Y. Deng, “Occurrence and exposure evaluation of perchlorate in outdoor dust and soil in mainland China”, Science of the Total Environment, 2014, 470-471. 99-106.


23. R. Calderon, P. Palma, K. Eltit, N. Arancibia-Miranda, E. Silva-Moreno, and W. Yu, “Field study on the uptake, accumulation and risk assessment of perchlorate in a soil-chard/spinach system: Impact of agronomic practices and fertilization”, Science of the Total Environment, 2020, 137411.
24. 화빈 김, 원진 심, 민영 김, and 정은 오, “IC와 LC-MS를 이 용한 퍼클로레이트 분석 방법 비교 및 모니터링”, 대한환경공학회지, 2008, 30 (1), 37-44.
25. 국립환경과학원, "환경시험·검사 QA/QC 핸드북", 2011, 환경부
26. ISO 5725-2:2019, "Accuracy (trueness and precision) of measurement methods and results - Part 2: Basic method for the determination of repeatability and reproducibility of a standard measurement method", 2019
27. W. F. Koch, “Sample preparation in ion-chromatography”, Journal of research of the national bureau of standards, 1979, 84 (3), 241-245.



28. G. M. Brown and B. Gu, "The chemistry of perchlorate in the environment", Perchlorate: Environmental occurrence, interactions and treatment, 2006, 17-47, Springer Science+Business Media, Inc., USA
29. S. Tefera, S. Ehling, and I. P. Ho, “Trace analysis of perchlorate anion in selected food products by reverse-phase liquid chromatography-tandem mass spectrometry”, Food Additives and Contaminants, 2007, 24 (11), 1203-1208.


30. US Environmental protection agency, Method 314.0 Determination of perchlorate in drinking water using ion chromatography, 1999.
31. P. Iannece, O. Motta, R. Tedesco, M. Carotenuto, and A. Proto, “Determination of perchlorate in bottled water from Italy”, Water, 2013, 5 (2), 767-779.

32. Official Journal of the European Union, Commission Recommendation (EU) 2015/682 of 29 April 2015 on the monitoring of the presence of perchlorate in food, 2015.






