알칼리 조건에서 흡광법 기반 구리와 아연의 순차정량법 개발
Sequential Spectrophotometric Determination of Copper (II) and Zinc (II) Ions in Alkaline Aqueous Solution
Article information
Trans Abstract
Zincon is widely used as a colorimetric reagent for determining the concentrations of heavy metals in aqueous solutions. Copper and zinc are often found in the same aqueous sample and zincon can be used to determine the concentration of both ions at different reaction pH conditions (e.g., pH 5 and 9). Reportedly, zincon forms a precipitate under acidic conditions, which may decrease the precision and accuracy of metal ion determination. In this communication, a novel sequential analysis technique for the determination of copper and zinc is reported. The precipitation problem was eliminated at a pH of 9, and the concentration of zinc ions was successfully determined by treating a copper-zinc binary mixture with zincon, and masking and demasking reagents. The concentration of copper ions was determined by treating the same copper–zinc solution with only zincon. The accuracy of the concentrations of copper and zinc ions determined using the proposed sequential analysis technique was ± 13%.
1. 서 론
구리와 아연은 모두 생물의 대사과정에 꼭 필요한 필수 영양소(essential element)로 결핍이 걱정되는 원소들이다. 하지만 과량 섭취 시 독성 물질(toxic material)로 구토와 복통을 일으킬 수 있다[1,2]. 구리는 원자 번호 29번이며 원소 기호는 Cu이고 아연은 원자 번호 30번이며 원소 기호는 Zn이며, 두 원소 모두 주요 산화 상태는 +2이다. 구리는 지각 중에 55 mg kg-1이 존재하며 환경 시료 중 토양 속에는 2~100 mg kg-1, 자연수에는 0.2 ~ 30 µg L-1 정도 존재하며 식품 중에는 10 mg kg-1 이하로 존재하여야 한다. 아연의 경우에는 지각 중에는 70 mg kg-1, 토양 중에는 10~300 mg kg-1, 하천수에는 10 µg L-1 정도 존재하며 지하수에는 100 µg L-1 이하로 존재한다[2]. 구리와 아연 모두 5 mg L-1 이상의 농도로 존재할 경우 쓴맛을 유발하며, 구리는 수도관의 부식에도 관여하는 것으로 알려져 있다[3,4]. 이와 같이 구리와 아연은 토양, 지하수, 하천수, 광물, 혈액 및 식품과 같은 시료에 동시에 존재하는 경우가 많으므로 서로 다른 농도비로 존재하는 두 화학종을 동시에 정량하는 측정 장치의 개발이 필요하다.
흡광분석법(absorption photometry)은 높은 정밀도와 정확도로 신속한 측정이 가능하므로 무기 및 유기 화학물의 미량 성분 분석에 널리 이용되고 있다. 흡광법을 이용하여 수질 내 중금속을 정량하고자 할 경우에는 킬레이트 시약과의 반응을 통해 색깔을 띠는 금속-킬레이트 착물을 먼저 형성하여야 한다. 생성된 착물과 보색이 되는 파장의 빛을 사용하여 흡광도를 측정하여 해당 금속이온의 농도를 정량할 수 있다. 흡광법은 원자흡광법[5], 원자형광법[6]이나 이온크로마토그래피법[7] 등에 비해 보다 단순한 기기구성, 저비용과 필드용 기기 개발의 용이성 등으로 인해 널리 이용되고 있다[8-10].
수질 내 구리이온과 아연이온은 진콘 (2-카르복시-2‘-하이드록시(hydroxy)-5’ 술포포마질-벤젠, 나트륨염) 시약을 이용한 흡광광도법과 착물 형성 반응 pH를 조절하여 개별 이온을 순차 정량할 수 있다. 진콘과 구리 및 아연 이온의 반응 결과 생성되는 화합물은 매우 안정한 청색 킬레이트 화합물로서 붉은색 광원 (590 nm~630 nm)을 사용하여 흡광도를 측정할 수 있다. 금속킬레이트 반응의 경우 금속별로 최적 반응 pH가 다르며 일반적으로 pH가 높아질수록 생성 착물의 안정도가 높아진다. 즉, 반응 pH 조절을 통해 특정 금속과의 반응성을 높이고 다른 금속 이온으로부터의 간섭을 줄여 선택성을 높일 수 있다[11]. 진콘의 경우 반응 pH를 9로 할 경우 구리와 아연 모두 안정한 착물을 형성하는 반면 반응 pH를 5로 조절할 경우 구리는 진콘과의 반응성을 강하게 유지하지만 아연은 진콘과의 반응성이 매우 낮아진다. 즉, pH를 5로 조절하면 구리와 아연의 혼합물에서 구리만의 선택적 정량이 가능해진다. pH 9의 반응조건에서는 구리와 아연의 총량을 구할 수 있으므로 아연의 정량도 가능해진다[12-14]. 하지만, pH 5의 반응 조건하에서 진콘은 주로 완전히 양성자화된 (fully protonated) 형태로 존재하면서 침전이 될 수 있으며, 이로 인해 발생하는 탁도 등으로 인해 흡광도 측정값의 정확도와 정밀도가 현저하게 떨어질 수 있음이 확인되었다[15]. 이를 해결하기 위하여 pH 5 조건하에서 진콘의 용해도를 높일 수 있는 에탄올이나 사이클로헥사논을 추가하기도 하지만[12,15] 진콘의 침전이 원천적으로 발생하지 않는 pH 반응 조건에서 구리와 아연을 순차 정량할 수 있는 방법은 매우 유용하게 사용될 수 있을 것이다. 진콘의 침전이 발생하지 않는 반응 조건인 pH 9에서 구리와 아연의 혼합물에서 구리와 아연을 순차 정량할 수 있는 방법은 흡수 스펙트럼을 얻은 후 여러 파장 (5 개 파장이상)에서의 흡광도 값과 개별 구리이온과 아연이온과의 농도 관계식의 연립 방정식을 풀어야 얻을 수 있다[16]. 이를 위해서는 대체로 착물의 넓은 범위의 파장에 걸친 흡수 스펙트럼을 얻을 수 있는 분광광도계의 이용이 필요한데, 이 접근은 간단한 필드용 분석 장치의 개발에 적용하기에는 비용면에서 적합하지 않을 수 있다.
본 단보에서는 진콘의 침전이 발생하지 않는 반응 조건인 pH 9에서 구리와 아연의 혼합물에서 구리와 아연을 순차 정량 할 수 있는 기법을 개발하였다. 즉, 구리-아연 혼합 용액을 pH 9로 조절한 뒤, 가리움제(masking reagent, CN-)와 가리움벗기기제 (demasking reagent, cyclohexanone)를 차례대로 처리하여 620 nm의 분석 파장에서 흡광도를 측정하여 아연만을 우선 정량하였다. 동일한 구리-아연 혼합 용액에서 구리를 정량하기 위해서 구리-아연 혼합 시료 용액을 pH 9 반응 조건으로 조절 후 진콘만을 사용하여 생성되는 착물의 흡광도를 620 nm의 분석 파장에서 측정하였다. pH 9에서 진콘만을 사용하여 측정한 구리-아연 혼합용액의 흡광도 수치는 구리와 아연의 총 농도를 반영하고 있으므로 적절한 식을 사용하여 구리만의 농도를 산출할 수 있게 된다.
2. 시약 및 실험 장비
2.1. 실험 장비 및 시약의 준비
구리와 아연 표준용액은 황산구리 오수화물 (CuSO4· 5H2O, 대정화금, 한국)과 염화아연(ZnCl2, Alfa Aesar, 미국)을 이용하여 농도가 1000 mg L-1이 되도록 제조한 후 필요한 농도로 추가 희석하여 구리 표준용액, 아연 표준용액 및 구리-아연 혼합 표준용액을 제조하는데 사용하였다. 구리-아연 혼합 표준용액은 구리와 아연이 모두 포함된 용액으로 아연과 구리 농도(µg L-1)가 각각 (0, 2000.8), (100.1, 100.0), (100.1, 500.2), (100.1, 2000.8), (500.5, 100.0), (500.5, 1000.4), (500.5, 2000.8), (1001.0 500.2), (1001.0, 1000.4), (1001.0, 2000.8)인 혼합용액을 제조하여 순차분석을 통한 구리와 아연의 농도를 정량 하는데 사용하였다. 진콘용액 (Zincon monosodium salt, Alfa Aesar, 미국)은 0.02 M 수산화나트륨(NaOH, Merck, 미국)를 용매로 하여 1.41×10-4M의 농도가 되도록 제조하여 사용하였다. pH 9 완충용액은 31.2 g의 붕산 (H3BO3, Sigma-Aldrich, 미국)과 8.4 g의 NaOH를 초순수 (Milli-Q, Merck) 1000 mL로 녹여 제조하였다. 구리-아연 혼합용액은 진콘과 바로 반응시켜 구리와 아연의 총 흡광도를 측정하거나 일명 Hach법(가리움제와 가리움벗기기제를 차례로 가한 후 진콘과 반응시켜 흡광도를 측정하는 방법, 이하 진콘-가리움제 방법으로 용어 통일함)을 사용하여 아연만의 양을 정량하는데 사용하기도 하였다. 가리움제로 시안화칼륨(KCN, Sigma-Aldrich, 미국, 1.00 g KCN/100 mL H2O)을 가리움벗기기제로 사이클로헥산논(Cyclohexanone, Sigma-Aldrich, 미국)을 사용하였다[17]. 금속-진콘 착물의 흡광도 측정과 흡수스펙트럼은 자외선/가시선 분광광도계 (Genesys 180, Thermo)를 이용하여 수행하였다. 흡광도 측정을 위한 흡수 파장은 620 nm를 이용하였다. 시료와 시약의 혼합 비율은 진콘과 직접 반응시킬 때(이하 진콘-직접법으로 용어 통일함)에는 금속용액 2 mL에 완충용액 1 mL를 가한 후 잘 섞어 준 뒤 마지막으로 진콘 용액 1 mL를 섞어 주었다. 진콘-가리움제 방법의 경우에는 다음 순서를 따랐다. 시료 (혹은 standard) 20.0 mL에 완충용액 (pH 9.0) 5.0 mL, KCN 2.0 mL, 진콘 3.0 mL를 차례대로 가한 뒤 잠시 기다린다. 이 용액을 둘로 나누어 처음 용액에는 가리움벗기기제인 사이클로헥산논을 1.0 mL를 가하여 잘 섞어 준 뒤 흡광도를 측정하였다. 이때, 사이클로헥산논을 가하지 않은 나머지 용액을 사용하여 %T = 100이 되도록 하였다. 사이클로헥산논을 첨가하지 않은 용액을 바탕용액으로 사용한 이유는 시료에 원래 존재하는 탁도 및 기타 간섭을 제거하기 위해서이다[17].
2.2. 구리-아연 혼합용액의 순차 정량
구리-아연 혼합용액의 순차 정량의 순서는 먼저 진콘-가리움제 방법을 사용하여 아연 농도를 결정한 뒤, 나머지 혼합용액은 진콘-직접법을 이용하여 흡광도를 측정한 뒤, 아래 수식 1을 이용하여 구리의 농도를 결정하였다. Fig. 1은 진콘-가리움제 방법을 사용하여 구리-아연 혼합용액에서 아연만 정량하는 원리를 그림으로 설명한 것이다. 즉, 구리와 아연을 함께 포함하는 시료용액을 가리움제인 CN로 처리하면 구리와 아연의 시안화 착물이 각각 생성된다. 여기에 다시 가리움벗기기제인 사이클로헥사논을 추가하면 Zn(CN)42-는 사이클로헥사논과 바로 반응하여 아연 이온이 유리되어 나온다. 즉, 가리움이 벗겨진 아연 이온은 용액 중에 있는 진콘과 바로 반응하여 푸른색 착물을 형성한다. 반면, Cu(CN)42-의 경우에는 사이클로헥사논과의 반응 속도가 느리므로 구리의 가리움이 벗겨져 유리된 구리 이온으로 벗겨지는 데에는 수분의 시간이 필요하게 된다. 따라서, 구리의 가리움이 벗겨지기 전에 아연-진콘 착물만의 흡광도를 측정하게 되면 구리-아연 혼합용액에서 아연만의 선택적 정량이 가능해진다. 즉, 아래 그림은 진콘-가리움제 방법에 대한 설명이라 할 수 있다.
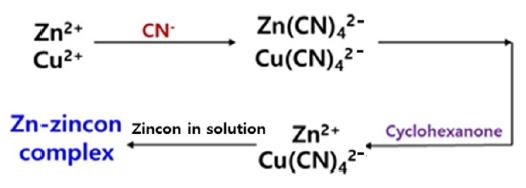
Graphical explanation of zincon chemistry with masking and demasking reagents. Only Zn(II) ions can react with zincon because Zn(CN)42- reacts immediately with a demasking reagent (i.e. cyclohexanone), and Cu(CN)42- takes longer (approximately a few minutes) to react with cyclohexanone and generate Cu(II) ions.
구리-아연 혼합용액에서 구리 이온의 정량 과정은 다음과 같다. 구리-아연 혼합용액의 총 흡광도는 개별 이온에 의해 발생하는 흡광도의 합과 같으므로 구리-아연 혼합용액을 진콘과 반응시킨 용액의 총 흡광도는 아래와 같은 식으로 표현할 수 있다.
상기 수식(Eq. 1)에서 A는 pH 9에서 진콘-직접법으로 측정된 구리-아연 혼합 용액의 흡광도이며, mCu와 mZn는 각각 진콘-직접법에 의한 구리와 아연의 개별 표준용액으로부터 얻은 검정곡선의 각 기울기에 해당한다. [Zn2+]는 진콘-가리움제 방법에 의해 결정할 수 있으므로 상기 식에 A, mCu와 mZn 값을 대입하면[Cu2+] 값을 결정할 수 있게 된다.
3. 결과 및 고찰
3.1. 금속-진콘 착물의 흡수 스펙트럼
흡광법을 이용하기 위해서는 적절한 파장의 선택이 중요하므로, 진콘, 구리-진콘 착물 및 아연-진콘 착물의 흡수 스펙트럼을 동일한 반응 pH 9 조건에서 얻었다. 구리-진콘 착물의 최대 흡수파장은 602.0 nm 근처이고 아연-진콘 착물의 최대 흡수파장은 617 nm 근처에서 확인되었다. 진콘만의 흡수스펙트럼은 이 영역의 파장을 적게 흡수함을 아래 Fig. 2에서 쉽게 확인할 수 있다. 진콘만의 흡수스펙트럼과의 겹침을 최소화하고 구리-진콘 착물과 아연-진콘 착물의 최대 흡수 파장에 가까운 파장을 선택할 필요에 따라 620 nm를 분석 파장으로 결정하였다.
3.2. 진콘-가리움제 방법에 의한 아연 검정곡선
구리-아연 혼합용액에서 아연의 정량은 아연 표준 용액 (100~2000 µg L-1)을 진콘-가리움제 방법으로 처리하여 얻은 검정곡선을 이용하여 이루어졌다(Fig. 3 참조). Fig. 3의 검정곡선 아래 추가된 표에는 해당 검정 곡선을 얻는데 필요한 흡광도 수치들과 진콘-가리움제 방법의 재현성 (%RSD, n = 4)을 나타냈다. 사용된 농도 범위에 대해 0.7%~2.1% 범위의 %RSD로 재현성이 매우 높음을 확인할 수 있다. 검정곡선은 y절편이 0.01585의 값을 보여주고 있는데, 이는 위에 기술된 바와 같이 사이클로헥사논을 가하지 않은 용액을 바탕용액으로 사용하였기 때문이다. 즉, 가리움벗기기제인 사이클로헥사논을 가한 용액과 가하지 않은 용액사이에서 진콘 시약의 농도 차이를 반영되었기 때문에 (사이클로헥사논 추가에 따른 묽힘 효과로 인해) y 절편 값이 0으로 수렴하지 않는 것이다.
3.3. 구리-아연 혼합용액의 순차 정량 결과
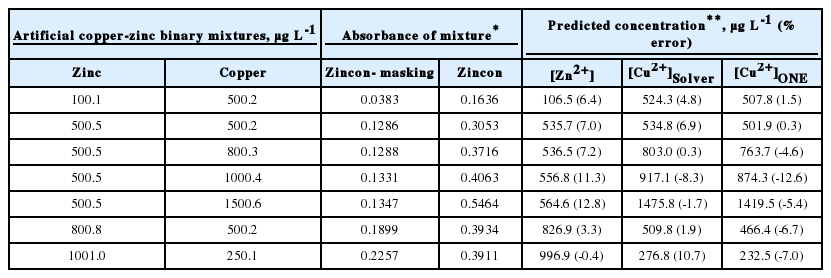
구리-아연 혼합용액을 진콘-직접법을 사용하여 흡광도를 측정하면 구리와 아연이 진콘과 모두 반응하여 푸른색 착물을 형성하므로 이들 농도 합에 해당하는 흡광도가 측정될 수 있다. Table 1에는 여러 가지 조성의 구리-아연 혼합용액을 진콘-직접법을 사용하여 처리 후 620 nm에서 측정한 흡광도 값 (measured)과 수식 1에 의해 예측되는 흡광도 수치 (predicted)를 나타냈다. 수식 1을 이용하여 구리-아연 혼합용액의 산출 흡광도 값(predicted)을 예측하기 위해서는 mCu와 mZn 값이 필요한데, 이 값은 엑셀의 해찾기 프로그램을 통해서 최적화할 수 있다. 이 과정은 곧 개별 혼합용액의 측정 흡광도와 수식 1에 의한 산출 흡광도가 가장 근사한 값이 나올 때까지 mCu와 mZn의 값을 연속적으로 변화시키는 과정이다. 엑셀 해찾기 프로그램은 개별 혼합용액의 측정 흡광도 수치(measured)와 예측 흡광도 수치(predicted)의 차이 값 (differential)을 제곱하여 모두 합한 수치가 최소가 될 때의 mCu와 mZn 값을 찾아 줄 수 있다[18]. 즉, Table 1에 예측된 흡광도 값 (predicted)은 이렇게 최적화된 mCu와 mZn 최종값 (Table 2 참조)을 수식 1에 대입하여 구한 값이다.
Table 2에는 위에서 설명한 엑셀 해찾기 프로그램과 단일용액 검정법 (one point calibration)을 통해 최적화한 결과 값 (mCu와 mZn)을 나타냈다. 단일용액 검정법을 통해 mCu와 mZn 값을 계산하기 위해 Table 1의 구리 표준용액 (2000.8 µg L-1)과 아연 표준용액(2001.9 µg L-1)을 이용하였다. 즉, 해당 용액의 흡광도 수치를 해당이온의 농도로 나눈 값이다. 엑셀 해찾기 프로그램을 통해 최적화된 수치를 기준으로 했을 때, 단일용액 검정법을 통해 구한 mCu와 mZn 값은 2.4~3.0%의 오차밖에 나지 않았다. 이는 혼합용액의 총 흡광도는 개별 흡광도의 합이 된다는 수식 1이 합리적인 가정이라는 것을 보여준다. 또한, pH 9의 반응 조건에서 진콘이나 기타 시약의 침전 등에 의한 탁도 발생이나 구리와 아연 간의 상호 간섭에 의한 반응성의 변화 등이 일어나지 않았음을 의미한다. 이렇게 최적화된 mCu와 mZn 값들을 이용하여 7가지 구리-아연 혼합용액에서의 구리 농도를 예측하였고 그 결과를 아래 Table 3에 정리하였다. Table 3의 아연 농도는 진콘-가리움 방법에 의한 검정곡선 (Fig. 3)을 사용하여 계산한 값이다.
진콘-가리움제 방법에 의한 예측된 아연 농도의 제조된 아연 농도 대비 오차율은 –0.4~12.8 % 범위를 보이고 예측된 구리 이온의 농도의 오차율 또한 최대값이 –12.6 % 정도여서 두 이온 모두 수질오염공정시험 기준에 의한 정확도 조건을 충분히 충족함을 확인하였다. 구리 이온 농도의 예측 정확도는 수식 1에 필요한 mCu과 mZn 수치를 얼마나 정확하게 산출하느냐에 의존한다고 할 수 있는데, Table 2와 3에서 나타난 결과와 같이 엑셀 해찾기 프로그램과 단일용액 검정 방법 둘다 큰 차이가 없는 것으로 나타났다. 하지만 Table 1과 3에서 측정된 혼합용액의 흡광도 값은 단회 측정 (n=1)으로 얻어진 것이므로 하나의 표준 용액만을 사용하는 단일용액 검정방법보다는 엑셀 해찾기 프로그램을 이용하여 mCu과 mZn 최적화하는 방법이 통계적으로 보다 유의미한 결과로 생각할 수 있다. 또한, 혼합용액 존재하는 중금속들로 인해 서로 간의 간섭을 발생하는 경우에는 엑셀 해찾기 프로그램을 이용하는 것이 정확도를 훨씬 높여 줄 수 있을 것이다.
4. 결 론
구리-아연 혼합용액을 pH 9 반응 조건에서 진콘-가리움제 방법과 진콘-직접법을 차례로 적용하여 아연과 구리의 농도를 순차적으로 정량하는 방법을 성공적으로 개발하였다. 진콘-가리움제 방법은 구리-아연 혼합용액을 가리움제 (CN-)와 가리움벗기기제 (Cyclohexanone)를 차례대로 처리하는 방법으로 결국 아연만 가리움이 벗겨져서 진콘과 반응하게 되고 이 반응의 결과 생성되는 푸른색 착물의 흡광도를 측정하여 아연만의 농도를 정량할 수 있다. 구리의 정량에는 보다 정교한 방법이 요구되었다. 즉, 혼합용액을 진콘-직접법을 통해 아연과 구리와 총 흡광도를 측정한 뒤 진콘-가리움제 방법으로 구한 아연의 농도와 엑셀 해찾기 프로그램을 통하여 최적화된 mCu과 mZn 값들을 수식 1에 대입 후 구리의 농도를 구하였다. 예측된 아연과 구리의 농도의 정확도는 모두 ±13% 이내로 확인되었다. 기존의 순차정량법은 pH 반응 조건을 5와 9로 조절하는 것이었다. pH 5에서는 진콘 시약의 침전이 발생할 수 있고 이는 흡광도 측정의 정확도와 정밀도를 저하시킬 수 있으므로 진콘의 침전이 발생하지 않는 반응 조건인 pH 9에서의 구리-아연의 정량을 위한 흡광법 기반 순차 정량법은 향후 활용 가치가 높다고 할 수 있다. 그러나 혼합용액에서 같이 존재하는 이온의 상대 농도가 높아질수록 오차율이 높아지는 경향성도 함께 보여주고 있다(Table 3 참조). 이는 진콘-가리움제 방법에서 y-절편을 0으로 할 수 있는 실험 조건을 적용하고 혼합 용액의 구리와 아연의 농도 비를 보다 다양화하여 측정한 흡광도 data를 엑셀 해찾기 프로그램에 적용하여 보다 최적화된 mCu와 mZn 수치를 수식 1에 대입하면 실험의 정확도를 보다 더 개선할 수 있을 것이다.
Acknowledgements
본 연구는 환경부 글로벌탑 환경기술개발사업 (그린패트롤 측정기술개발사업단)의 지원으로 수행되었으며, 이에 감사드립니다 (2018001840001).