구연산 pH 조절제를 이용한 연속식 차아염소산 전해수 발생장치의 소독효과 및 소독부산물 생성 특성
Disinfection Effects and Disinfection by-products Generation Characteristics of a Continuous Hypochlorous Acid Water Producing Device Using Citric Acid as a pH Control Agent
Article information
Trans Abstract
The use of disinfectants and disinfecting devices is becoming increasingly common in homes as they prevent the development and spread of pathogens while improving hygiene. Common disinfectants include chlorine compounds, alcohol, and quaternary ammonium compounds. Among them, chlorine compounds are easily manufactured and commonly used in the form of sodium hypochlorite. When chlorine compounds are dissolved in water, free chlorine divides into hypochlorous acid and hypochlorite ions with different molar fractions depending on solution pHs. Maintaining a high hypochlorous acid fraction by adjusting the solution pH is crucial as hypochlorous acid is more than 100 times more effective as a disinfectant than hypochlorite ions. However, due to the chemical nature of its conversion to hypochlorite ions, hypochlorous acid is not very stable, making it more efficient to prepare and consume it at the time of use. In this study, we used citric acid as a pH adjuster to determine the optimal conditions required for producing electrolyzed water. We built a device capable of continuously producing electrolyzed water containing hypochlorous acid, and we analyzed the efficiency of the produced electrolyzed water using disinfection tests and measurements of disinfection by-products.
1. 서 론
인구의 증가와 환경의 변화로 인류는 지속적이고 새로운 전염병 유행을 경험하고 있다. 이에 따라 국가적 차원의 방역을 넘어 개인 생활 환경에서의 소독에 대한 사람들의 관심도 높아지고 있다. 소독의 경우 병원균 발생과 전파를 차단하고 개인 위생에 도움을 주기 때문에 최근에는 일반 가정에서도 소독제 및 소독 기기를 사용하는 사례가 증가하는 추세이다. 또한 산업 분야 중 식품과 관련된 작물 제배 및 식품 가공 공정에서도 소독은 필수적인 과정으로 사용된다[1]. 이러한 소독을 목적으로 사용되는 소독제로는 염소화합물, 알코올, 4급 암모늄 화합물, 과산화물, 페놀 화합물 등이 있다[2]. 이 중 염소화합물은 정수처리공정에서 위생적인 수돗물을 생산하기 위한 목 으로 1800년대부터 지금까지 도 사용 중인 가장 보편적인 소독제이다[3].
염소화합물 중 가장 대표적인 유리염소(free chlorine)는 염소가스(Cl2)가 물에 용해되어 생성되는 차아염소산(hypochlorous acid; HOCl)과 차아염소산이온(hypochlorite ion; OCl−)을 통칭한다. 이들 두 물질은 pH에 따라 몰(mole) 분율이 다르게 나타나며 pH 7.4에서 두 물질의 분율은 같고 pH가 7.4보다 높아지면 OCl−의 분율이, 그리고 pH가 7.4보다 낮아지면 HOCl의 분율이 커진다[4,5]. 일반적으로 소독능 관점에서는 HOCl이 OCl− 보다 유용하다고 평가되는데, 그 이유는 HOCl이 OCl− 보다 살균력이 약 100배가량이나 더 강하기 때문이다[6]. 따라서 소독을 목적으로 유리염소를 사용할 경우, pH 5~6 정도의 약산성을 띄는 차아염소산수를 제조하는 것이 유리하다. HOCl 분자는 전하를 갖고 있지 않고 분자량이 상대적으로 낮기 때문에 OCl−를 비롯한 다른 염소화합물 소독제보다 미생물의 세포벽 침투가 용이하다. 여기에 더해 미생물 세포의 중요한 구성 요소인 유기물과의 산화 반응에 있어서도 다른 염소화합물 소독제들보다 더 빠르다[32]. 이러한 장점을 가진 HOCl은 다른 염과의 화합물 구성이 어렵고 자연적으로 OCl−로 분해되는 화학적 특성 때문에 안정성이 다소 낮아서 장기간 보관 시 농도가 감소하는 문제가 있다[3]. 따라서 사용 시점에 직접 제조하여 사용하는 것이 가장 효율적이다. 또한 인체에 직접 사용하는 경우 저농도의 차아염소산수가 필요하지만 아직까지 재현성 있는 HOCl 용액의 제조에 대한 연구가 미비하기 때문에 이를 의료용 및 산업용으로 이용하기 어려운 상황이다.
저농도 약산성 차아염소산수 제조에 있어서 재현성이 어려운 이유는 차아염소산수를 직접 제조하기 위한 방법인 전기분해(electrolysiss) 과정에서 일어나는 전기화학반응(electrochemical reaction) 때문이다. 염소 생성에 가장 일반적으로 사용하는 전해질인 염화 나트륨(sodium chloride; NaCl)이 용해된 수용액에 양극(anode) 전극과 음극(cathode) 전극을 침지 한 후 전압을 가해주면, 양극에서 염소이온(Cl−)이 산화되어 Cl2 가스가 발생하면서 HOCl/OCl−를 생성하게 된다[식 1 - 3]. 이 때 음극에서는 물분자가 전자와 반응하여 수소(H2) 가스와 수산화이온(OH−)으로 환원된다. [식 4] [7]
결과적으로 물의 전기분해 과정동안 생성되는 OH−로 인해 전체적인 수용액의 pH가 증가함에 따라서 HOCl/OCl−의 pKa 값에 의해 소독능이 감소하게 되는 것이다. 물론 이러한 전기화학반응에 대한 이해를 바탕으로 pH 조절제를 첨가한 미산성 차아염소산수에 대한 연구가 진행되고는 있지만 취급이 어려운 황산이나 염산과 같은 강산을 pH 조절제로 사용하거나, 전해질에 미리 pH 조절제를 주입하고 전기분해를 통해 차아염소산수를 생성하는 방법이 대부분이다[33]. 게다가 이와 같은 방법으로 제조된 차아염소산수의 소독부산물과 같은 수질 특성을 연구한 사례는 거의 없고, 기존 전기분해 차아염소산수 생성 연구에 사용된 장치는 대부분 회분식 형태여서 사용자 수요에 맞는 생산량 조절이 쉽지 않다[6]. 그리고 차아염소산 생성 후 저장에 따른 부산물 발생이나 농도 저감에 대한 문제점이 항상 거론되어왔다[8].
따라서 본 연구에서는 이러한 문제를 해결하기 위하여 연속적으로 차아염소산수를 생성할 수 있는 전극 모듈과 이를 적용한 발생 장치를 개발하였다. 그리고 개발한 연속식 차아염소산수 제조 장치에 사용되는 전해질에 pH 조절을 위한 구연산을 도입하여 미산성 차아염소산수 생성 조건을 확립하였으며, 최종적으로 생성된 차아염소산수의 소독 효과와 소독부산물 생성 특성을 알아보았다.
2. 재료 및 방법
2.1. 연속식 차아염소산수 생성 장치
본 연구에서는 표면 구조를 개선한 백금도금의 티타늄 전극(Pt/Ti)을 이용하여 연속식 차아염소산수 발생 장치에 적합한 전극을 개발했다(Figure 1a). 해당 전극을 polycarbonate(PC) 재질의 전극 가이드 양면에 부착하여 HOCl/OCl− 생성 모듈을 제작하였으며, 제작한 모듈은 HOCl/OCl− 농도 조절이 가능하도록 설계하였다(Figure 1b). 모듈의 전극 가이드에 전해질 공급과 생성 차아염소산수 연속 배출이 가능한 세 개의 line port를 설계하였으며, 각각 전극에 전해질을 공급하는 in-line, 차아염소산수를 배출하는 out-line, 그리고 용액의 순환과 배수가 가능한 drain-line으로 구성했다.
모듈 제어장치를 구성하고 있는 메인보드, 전류제어보드, 전자계전기(relay), 전원공급장치(switched mode power supply; SMPS)의 경우 아두이노(Arduino)를 사용하여 직접 프로그래밍을 통해 HOCl/OCl− 생성 전극을 제어할 수 있도록 설계하였으며(Figure 1c), 장치 구동을 위한 메인보드와 전류제어보드의 동작신호 및 전류 세기 전달 프로그램 로직은 Figure 1d에 나타냈다. 실험 장치 구성도는 Figure 1e에 나타냈으며, 유속에 따른 HOCl/OCl− 생성 특성을 확인하고 이를 통해 최적의 유속 조건을 도출하기 위해 정량 펌프(EMP-2000W, EMS Tech)를 사용하였다. 최종적인 개발 장치는 연구를 통해 도출된 운전 조건이 적용 가능하면서 사용자의 편의를 도모하기 위한 가정용 정수기 타입의 시스템을 도입하였고(Figure 1f), 일반적인 정수기의 평균 유속은 1,000 ~ 1,200 mL/min로 확인됐으며 개발한 차아염소산수 생성 장치는 유속 조절이 가능하도록 설계 제작하였다.
2.2. 시약 및 분석
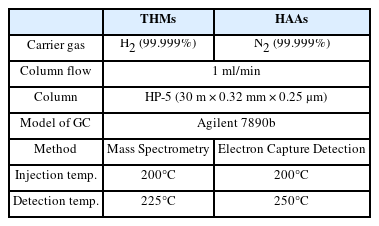
본 연구에서는 차아염소산수 제조를 위해 염화 나트륨(NaCl)과 구연산(Citric Acid)을 사용하였고, 이들 전해질을 이용해 개발한 장치로 제조한 차아염소산수의 HOCl/OCl− 농도는 DPD 시약을 이용한 비색법으로 분광광도계(DR6000, HACH) 를 이용하여 분석했다. 잔류 차아염소산 농도를 제거하기 위한 퀜칭(quenching) 용액은 0.1N 티오황산나트륨(Sodium Thiosulfate)을 사용하였고, 시료 50 mL에 퀜칭제 0.16 mL를 주입하여 잔류 차아염소산의 소독부산물 생성 반응을 종료 시켰다. 대표적인 소독부산물인 트리할로메탄(trihalomethanes; THMs)과 할로아세틱에시드(haloacetic acids; HAAs)는 기체크로마토그래피(gas chromatograph)로 분석했다(Table 1). 차아염소산수의 소독효과를 평가하기 위해, ASTM-E2315 time-kill test standard에 기초하여 황색포도상구균(Staphylococcus aureus, ATCC 653)을 대상 박테리아로 선정하고 이에 대한 불활성화율을 한국분석시험연구원을 통해 수행했다. 황색포도상구균 초기 균수는 106 이상으로 하였고, 제조한 차아염소산수와 22(±2)oC 온도 조건에서 30초 반응 후 균 감소율(%) 및 Log10 감소율을 통해 불활성화 효율을 분석했다. 모든 사용 용액의 pH는 Thermofisher orion A211 장비를 이용해 측정하였다.
3. 결 과
3.1. 조건 별 유리염소 생성 특성
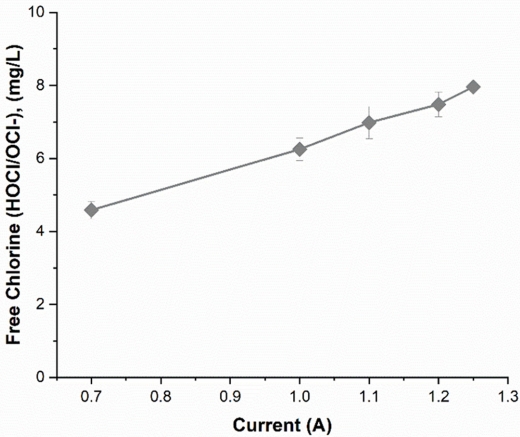
Figure 2에는 차아염소산수 제조 장치의 전극 모듈 전압을 12 V로 고정시킨 후 전류를 변화시키면서 생성되는 유리염소(HOCl/OCl−)의 농도를 나타냈다. 실험에 사용된 전해질인 NaCl의 농도는 향후 본 개발 장치의 활용성을 감안하여 인체 점막에 자극을 주지 않는 범위를 고려한 1.0%로 설정하였고[29], 전해질 용액 유속은 도입한 정수기 타입 장치의 초기 설정 조건인 1,150 mL/min으로 하였다. 실험 결과에서 알 수 있듯이 공급된 전류의 세기에 따라서 생성되는 유리염소의 농도는 선형적으로 비례하는 경향을 보였다. 본 연구의 목적인 저농도 차아염소산수 제조를 위해서 약 6 mg/L의 유리염소가 생성되는 조건의 전류로 확인된 1.0 A를 최적 공급 전류 값으로 선정하였다.

Components of continuous-flow hypochlorous acid water generator. (a) Electrode components, (b) assembled electrode module, (c) control module, (d) operating programming and the segment of stop and operating status, (e) schematic diagram of the system, (f) assembled continuous hypochlorous acid water production module
앞선 실험에서 도출된 전압, 전류와 전해질 농도 조건들을 바탕으로 연속식 차아염소산 생성 장치의 유속을 정확히 제어하고 변화해가면서 유리염소 생성 농도와 함께 pH값 변화를 확인하였다 (Figure 3a). 이번 실험에서는 소독효율을 극대화 할 수 있는 최적의 pH값 설정을 위한 각 조건에서의 pH값을 함께 측정하였으며, 개발 모듈에서 각 유속에 따른 전해질과 전극의 접촉시간도 측정하여 나타냈다 (Figure 3b). 이는 곧 모듈 안에서 전해질 용액의 체류 시간이며 실질적인 전기분해 반응 시간을 의미한다. 실험결과에서 알 수 있듯이 600 mL/min에서 1,800 mL/min까지 유속을 증가시켰을 때 시료의 pH 변화는 크게 없었고 평균 8.1로 측정되었다. 유리염소의 농도는 유속이 증가함에 따라 선형적으로 감소하는 결과를 나타냈다. 실험 조건들 중에서 목표 유리염소 농도인 6 mg/L에 가장 가까운 1,200 mL/min를 최적 유속으로 결정하였다[34].
3.2. 구연산을 이용한 pH 조절
앞서 확인한바와 같이 이번 연구에서 적용한 전기분해 조건에서는 pH 값의 변화가 미비했지만, 초기 전해질 pH 7.6에 대비해서는 전기분해 반응 후 0.5 가량 pH값이 상승하였음을 알 수 있었다. 즉, pH값이 증가한 만큼 차아염소산의 농도는 감소하고, 이에 따라 소독능도 감소할 것으로 예상할 수 있다. 따라서 최종 전해 차아염소산수의 소독능 확보를 위해 목표 pH를 6까지 낮추기 위한실험을 진행하였다. 구연산은 분자식, C6H8O7 3개의 카르복실기를 가진 약산이다. 구연산은 약산이라는 특성 때문에 식품 산업에서 재료의 세척이나 제품 소독에 이미 사용되고 있는 안정성과 취급용이성이 검증된 물질이다. 기존 pH 조절제로 많이 사용하는 염산과 황산에 비해 위험도가 낮아서 일반 가정집이나 공공장소, 공공시설에서도 사용이 용이하다. 추가적으로 구연산은 고체 형태로 존재하기 때문에, NaCl과 혼합된 분말 형태로 사용자에게 제공하여 손쉽게 전해질 용액을 준비할 수 있다는 장점이 있다. Figure 4는 구연산 주입량에 따른 pH 감소 정도와 와 유리염소 생성에 미치는 영향을 조사한 결과이다. 예상과 마찬가지로 구연산 주입량 증가시 pH는 감소하였고 다만, 유리 염소 생성 농도에는 별다른 영향이 없었다. 따라서 목표로 한 pH값 6에 가장 가까운 5.9를 나타낸 구연산 6 mg/L를 최적 주입량으로 선정하였다. 지금까지 도출된 최적 조건들을 개발 장치에 적용하여 전해 차아염소산수를 제조하였고, 이를 활용한 소독 효율 평가와 소독부산물 생성 특성을 분석하였다.

(a) Concentration of free chorine, pH, and (b) contact time as a function of flow rate, ([NaCl]0 = 1.0%, constant voltage = 12 V, supplied current = 1.0 A)
3.3. 소독 효율 및 소독부산물 생성 특성
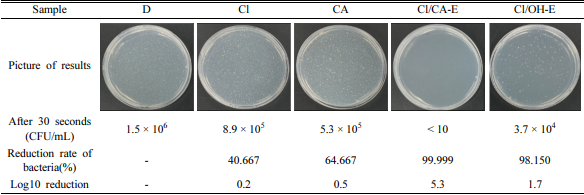
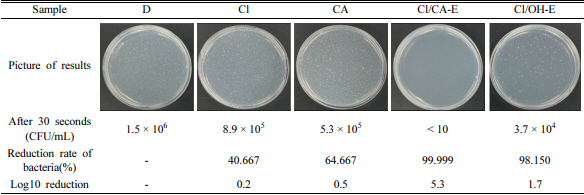
증류수 시료 D는 대조군으로 함께 시험을 진행했으며, 전기분해 반응을 하지 않은 전해질에서도 일부 소독 효과가 확인되었고 구연산이 NaCl에 비해서 0.3 log reduction 높은 소독 효율을 보였다. 하지만 역시 전기분해 반응을 통해 차아염소산이 생성된 시료에서 높은 소독 효율을 나타냈고, 특히 구연산으로 pH를 조절하여 pH가 낮은 Cl/CA-E 시료가 가장 높은 소독 효율을 보였다. 이는 pH 9를 나타낸 Cl/OH-E 시료에 비해서 pH 6인 최적 조건 시료에 더욱 높은 농도의 차아염소산이 존재하기 때문에 보다 높은 소독 효율을 나타낸 것이다. 따라서 전기분해를 통해 제조하는 소독제의 pH 조절이 소독 효율에 매우 중요한 인자임을 확인할 수 있었다.
소독제 사용에 있어서 안전성에 가장 큰 고려 사항인 소독부산물 생성 평가를 위해서, 소독 시험에 사용한 동일한 조건의 시료들의 최종 소독부산물 생성 농도를 확인하였다. 단, 실용성 측면을 고려하여 사용 원수는 먹는 물 수질 기준에 적합한 상수용 지하수를 선정하여 증류수와 비교 평가하였으며, 사용 지하수의 수질 성상은 아래 Table 3에 나타낸 바와 같다.
소독부산물 생성 평가시료는 앞서 언급한 원수를 증류수(D)와 지하수(G)로 나누고, 각각 염화 나트륨만 넣고 전기분해 한 경우(D-Cl & G-Cl), 구연산만 넣고 전기분해 한 경우(D-CA & G-CA), 둘 다 사용하여 전기분해 반응 종료 후 잔류 차아염소산 체류시간(차아염소산 퀜칭을 통한 농도 배제 유무)을 다르게 한 경우(바로 퀜칭: D-Cl/CA(0) & G-Cl/CA(0), 24시간 후 퀜칭: D-Cl/CA(24) & G-Cl/CA(24)) 이렇게 총 8개 시료를 준비하여 각각의 THMs과 HAAs 농도를 분석하였다 (Figure 5).

Concentration of free chorine and pH as a function of citric acid concentration. ([NaCl]0 = 1.0%, constant voltage = 12 V, supplied current = 1.0 A, Flow rate = 1,200 mL/min)
먼저 증류수로 준비한 시료의 경우, 구연산을 주입하지 않고 염화 나트륨만 전해질로 사용한 D-Cl시료와, 구연산을 주입하여 pH를 조절하였지만 전기분해 반응 후 바로 차아염소산을 퀜칭한 D-Cl/CA(0) 시료에서 모두 먹는 물 수질 기준 0.1 mg/L 이하의 THMs과 HAAs가 검출되었다. 물론 구연산만 넣고 전기분해한 D-CA(24) 시료의 경우는 차아염소산 농도가 낮기 때문에 순수한 구연산이 기여하는 소독부산물 생성 정도를 파악하기 위해 24시간 시료를 방치 후 THMs과 HAAs를 분석하였다. 구연산이라는 유기산에 의한 소독부산물 생성 영향이 미비하게 있긴 하지만 역시 차아염소산 소독제 농도가 소독부산물 생성에는 가장 큰 영향을 미친다는 것을 알 수 있었다. 그러나 pH 조절제로 구연산을 사용하고, 전기분해 반응으로 생성된 차아염소산이 잔류한 상태로 24시간 방치한 D-Cl/CA(24) 시료에서는 THMs 0.52 mg/L, HAAs 0.41 mg/L로 기준치의 4~5 배에 달하는 소독부산물이 검출되었다. 따라서 연속식으로 차아염소산 전해수를 필요할 때 제조하여 현장에서 바로 사용하는 것이 소독부산물 생성 위험성을 낮출 수 있는 가장 효과적인 방법임을 알 수 있었다. 다음으로는 동일한 조건에서 사용 원수만 지하수로 변경하여 준비한 시료들에서는, 앞선 결과와 동일하게 염화나트륨만 주입한 G-Cl, 구연산만 넣은 G-CA(24), 그리고 구연산 pH 조절제를 넣고 전기분해 반응 후 바로 잔류 차아염소산을 퀜칭한 G-Cl/CA(0) 시료에서 먹는 물 수질 기준 이하의 THMs과 HAAs가 검출되었고, 역시 마찬가지로 24시간 방치한 G-Cl/CA(24)에서는 먹는 물 수질 기준 이상의 소독부산물이 검출되었다. 하지만 흥미로운 사실은 Table 3에서도 나타낸 바와 같이 이번 실험에 사용한 지하수에는 TOC 2.47 mg/L 등, 증류수에 비해 높은 유기물 농도가 함유되어 있음에도 불구하고 소독부산물 생성 농도는 증류수에 비해 낮게 검출되었다는 점이다. 이러한 결과의 이유는 아래 제시한 식 (5)와 (6)을 통해서 설명할 수 있다.
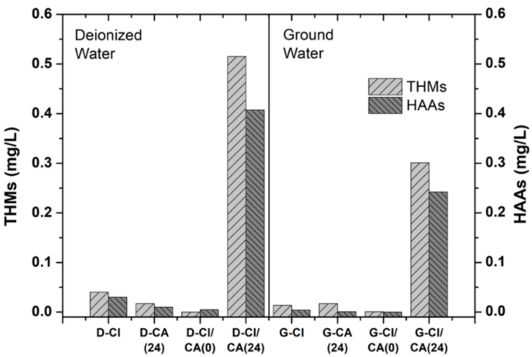
Concentration of generated disinfection byproduct, THMs, and HAAs (D: deionized water, G: ground water, Cl: sodium chloride, CA: citric acid, (0): quenching right after electrolysis, and (24): quenching after 24-hour retention after electrolysis).
지하수 알칼리도 7.50 mg/L에 포함된 탄산수소염(HCO3‒)은 주입된 염화 나트륨과 반응하여 탄산수소나트륨(NaHCO3)을 생성하게 되고[식 (5)], 탄산수소나트륨은 동시에 주입된 구연산과 반응하여 이산화탄소 기체 형태로 변환되어 기체-액체 평형에 의해 대기중으로 일부 소실되었을 것으로 판단된다 [식 (6)]. 이를 수화학적인 Carbonate System에 근거한 알칼리도 및 탄산수소염 농도 관계식에 대입한 후 양론적으로 계산을 해보면, 대략 2 mg의 구연산이 소실되었음을 알 수 있다. 결론적으로 동일한 조건의 6 mg/L의 구연산을 증류수와 지하수에 주입한 후 pH를 측정해 보았을 때 각각 5.92와 6.87로 pH 1 이상의 차이를 보임에 따라, 지하수를 사용한 G-Cl/CA에 비해 증류수를 사용한 D-Cl/CA에서 더 높은 소독부산물이 생성될 수 있음을 알 수 있었다. 따라서 일부 소실된 구연산이 소독부산물 형성에 영향을 미쳤을 것으로 판단된다.
4. 결 론
본 연구를 통해 연속적으로 전해수를 생성할 수 있는 장치를 제작하고 최종적으로는 높은 소독효율과 낮은 소독부산물 생성 위험성을 갖는 저농도 차아염소산수 연속 제조 시스템을 개발하였다. 실험을 통해 5~6 mg/L의 차아염소산수를 연속으로 생성할 수 있는 시스템의 최적 조건은 전압 12 V, 전류 1.0 A, 유속 1,200 mL/min, 전해질 1.0% NaCl로 도출되었다. 해당 조건을 통해 생성된 차아염소산수의 pH는 8이상으로 확인되었고, 이를 차아염소산의 분율을 높여 소독 효율을 향상시기키 위해서 구연산 6 mg/L를 주입해 pH 6으로 조절하였다. 결론적으로 구연산을 주입한 pH 6의 전해수에서 황색포도상구균을 대상으로 5-log 이상의 높은 소독효율을 나타냈다. 소독부산물 생성 평가에서는 원수 종류 및 pH 조절제 구연산의 주입 유무에 따른 THMs과 HAAs 소독부산물 생성 특성을 분석했다. 증류수와 지하수 두 시료 모두에서 전기분해 후 바로 사용한 전해수에서는 소독부산물이 먹는 물 기준 이하로 검출되었지만, 24시간 방치한 전해수의 경우에는 모두 먹는 물 수질 기준을 초과한 THMs과 HAAs가 검출되었다. 따라서 연속적으로 차아염소산수를 제조하여 현장에서 바로 소독제를 사용하는 것이 소독부산물 안정성 측면에서도 타당함을 밝힐 수 있었다. 개발 장치의 운영 비용 측면에서 수돗물 보다는 다소 유기물 함량이 높을 가능성이 있는 지하수를 사용할 시 보다 높은 농도의 소독부산물 생성에 기여하는 것이 아닌지 우려하였으나, 본 연구에서는 수질 성상 중 대표적인 알칼리도 유발 물질인 탄산수소염이 구연산과 반응하여 pH를 높여서 오히려 소독 효율에 영향을 미칠 수 있다는 사실을 발견하였다. 따라서 본 연구개발 장치를 활용 시 반드시 현장에서 사용할 원수에 대한 수질 특성을 면밀히 분석하여 최적 효율을 달성하기 위한 운전 조건을 수립해야 하겠다. 다양한 산업과 장소에서 그 중요성과 수요가 증가하고 있는 소독제 분야에, 본 연구에서 제시한 연속식 차아염소산 전해수 발생장치가 적극적으로 활용되기를 기대해본다.
감사의 글
본 논문은 2023년도 교육부의 재원으로 한국연구재단의 지원을 받아 수행된 지자체-대학 협력기반 지역혁신사업의 결과입니다.(2023RIS-005)