LC-HRMS를 이용한 송사리 내 의약품 농축 및 생체변환 연구
Bioconcentration and Biotransformation of Pharmaceuticals in Oryzias latipes using Liquid Chromatography-High Resolution Mass Spectrometry (LC-HRMS)
Article information
Trans Abstract
The occurrence of pharmaceuticals in the aquatic environment has been increasing steadily owing to the increasing use of pharmaceuticals in our daily life. This results in increasing challenges of environmental health risk as pharmaceuticals in the surface water can be accumulated and transformed in aquatic organisms. The purpose of this study was to predict the bioconcentration and biotransformation of several pharmaceuticals in Japanese medaka (Oryzias latipes) using a 96 h exposure test. Based on an investigation of the most frequently detected pharmaceuticals in the surface waters in South Korea, 11 target compounds were selected including atenolol, caffeine, carbamazepine, diclofenac, fluoxetine, irbesartan, losartan, mefenamic acid, metoprolol, naproxen, and venlafaxine. A bioconcentration factor of 1.9, 31.3, and 10.7 was expected in fish owing to the accumulation of carbamazepine, fluoxetine, and mefenamic acid, respectively. A total of 12 biotransformation products (BTPs) were tentatively identified via oxidation, hydroxylation, dealkylation, and demethylation reactions. In summary, it is expected that these BTPs represented by molecular structures derived from their parent compounds can be utilized to evaluate the change in toxicity of BTPs compared to that of the parent compounds.
1. 서 론
질병의 치료 및 예방을 위해 사용되는 의약품은 현대인들에게 필수적인 화학물질 중 하나이다. OECD (Organisation for Economic Co-operation and Development) Health Statistics 2020에 따르면 최근 10년 동안 국내 의약품 소비량은 꾸준히 증가하는 추세를 보였다[1]. 그 중에서도 사용량이 상대적으로 높은 소염진통제, 고혈압/고지혈/심혈관 치료제, 항우울제 등은 주로 하수처리장 방류수를 통해 환경 중에 유입되는 것으로 알려 져있다[2]. 기존 조사연구에 따르면, 국내 주요 하천인 한강, 낙동강, 영산강 등에서 의약품이 빈번하게 검출되어 왔다[3-6]. 환경 중으로 유입된 의약품은 다양한 전달경로를 거친 후 수계에 잔류하여 수서생물 내에 축적되거나 변환될 수 있으며, 잠재적인 수서 생태계 위험요소로 인지되고 있다[7].
국내 지표수에 널리 분포하고 있는 송사리(Oryzias latipes)는 담수지표종으로 우리나라, 일본, 중국 등 아시아 지역에서 주로 발견되며, 국내에서는 낙동강이나 동해안으로 유입하는 하천 유역에 주로 분포하는 것으로 알려져 있다[8]. 송사리는 US EPA (United States Environmental Protection Agency)와 OECD 등에서는 물벼룩(Daphnia magna)과 함께 오랫동안 생태독성연구를 위한 표준시험종으로 사용되고 있어 풍부한 독성관련 정보가 구축되어 있다. 물벼룩의 경우, 송사리에 비해 보다 많은 생태독성관련 정보를 가지고 있으나, 개체의 biomass가 적고 생물농축연구 사례가 적어 의약품 등 소수성(hydrophobicity)이 낮은 물질의 생물농축 및 대사체 형성 연구에는 많은 한계를 가지고 있다[9]. 반면, 송사리는 물벼룩에 비해 최소 수십 배 높은 체적 및 질량을 갖고 있고, 상대적으로 높은 지방 함량을 가지고 있어 유기화학물질의 생물농축에 적합한 조건을 갖추고 있다. 표준시험종으로서 송사리의 이러한 장점은 생물농축 및 대사체 연구에 적극적으로 적용될 수 있을 것으로 기대된다. 송사리의 대사체 관련 정보는 개체에서 확인된 독성 및 영향정도를 해석하고 독성기작에 대한 이해를 확장시키는데 활용될 수 있다.
최근 액체크로마토그래피-질량분석기(Liquid chromatography-mass spectrometry, LC-MS)의 발전으로 인한 정확도 높은 분석기법은 환경시료에 존재하는 극미량의 물질 분석도 가능케 하였다. 특히, 고분해능 질량분석기(High resolution mass spectrometry, HRMS)는 100,000이상의 분해능과 mass error 5 ppm 이하의 질량 정확도를 가지기 때문에 다성분 동시분석이 가능하며, 생물시료와 같은 매질효과(matrix effect)가 큰 시료의 미량오염물질 검출에도 적절하다[10].
따라서 본 연구는 담수지표종 중 하나인 송사리를 대상으로 국내 지표수에서 빈번하게 유의한 농도로 검출되는 의약품 중 검출 빈도, 검출 농도, 의약품의 소수성을 고려한 점수화를 통해 실험 물질로 선정한 의약품에 대한 노출 및 생물농축실험을 수행하고, 체내에 형성되는 생체변환물질(biotransformation products, i.e., 대사체)을 확인하여 해당 물질의 생물 내 거동을 관찰하고자 한다. 선정된 실험대상물질 및 대사체 분석은 LC-HRMS를 기반으로 한 표적, 추정 및 비표적 분석기법(target, suspect & non-target screening)을 활용하여 수행하였다.
2. 재료 및 방법
2.1. 연구대상물질 선정
연구에 사용할 의약품 선정을 위해 2010년 이후 발표된 학술논문 중 국내 및 국외 미량오염물질 수계 모니터링을 수행한 연구를 조사하였으며, (1) 하수처리장 방류수 및 지표수의 미량오염물질을 분석; (2) 의약품의 정량분석 및 수계 검출 농도를 제공한 논문에서 보고된 의약품의 검출빈도, 검출농도, Log Dow을 기준으로 환경 중 모니터링이 필요한 의약품에 대해 점수화 하였다[11].
문헌 조사의 결과로는 122개 의약품이 점수화를 위한 물질로 고려되었으며, 검출빈도 점수화를 위한 기준의 설정은 조사한 논문에 보고된 전체 의약품 중 해당 의약품의 검출빈도가 0% 이상 25% 미만일 경우 25점, 25%이상 50% 미만일 경우 50점, 50% 이상 75% 미만일 경우 75점, 75% 이상일 경우 100점을 부여하였다. 다음으로 검출농도에 대한 점수화를 위한 기준의 설정은 US EPA에서 보고된 급성 독성 농도를 참고하여 적절한 점수 기준을 분배하였다[12]. 기준을 위한 고려사항으로는 독성이 강한 물질(노출시간 96시간 인 급성독성값 기준)이 수계 중에 높은 농도로 존재하여 생물에 노출될 경우, 낮은 농도로 존재할 때보다 위해성이 높을 것으로 예측하고 우선순위선정에 반영하였다. 따라서 조사된 의약품이 수계에 존재하는 농도가 100 ng/L 미만일 경우 25점, 100 ng/L 이상 1,000 ng/L 미만일 경우 50점, 1,000 ng/L 이상 10,000 ng/L 미만일 경우 75점, 10,000 ng/L이상일 경우 100점으로 하였다. 마지막으로, Log Dow에 의한 점수화에서는 Log Dow가 3.5 미만인 물질은 25점, 3.5 이상 4 미만인 물질은 50점, 4 이상 4.5 미만인 물질은 75점, 4.5 이상인 물질은 100점으로 하였다. 그 결과로 총 122개 물질이 검출빈도 점수화를 위한 과정에서 확인되었고, 이후 검출농도와 Log Dow 값을 고려한 점수화 총합을 통하여 11개 물질을 본 연구를 위한 연구대상물질로 선정하였다(Table 1).
2.2. 시약 및 표준용액
연구에 사용된 표준물질은 11종으로, atenolol (ATN), caffeine (CFE), carbamazepine (CMZ), diclofenac (DCF), fluoxetine (FLX), irbesartan (IBS), losartan (LST), mefenamic acid (MFA), metoprolol (MTP), naproxen (NPX), venlafaxine (VFX)이었으며, 이 중 LST (Toronto research chemicals, North York, Ontario, Canada)을 제외한 모든 표준물질은 Sigma-Aldrich(St Louis, MO, USA)에서 구입하였다. 내부표준물질로 사용된 atenolol-d7, carbamazepine-13C6 solution, fluoxetine-d5 solution, mefenamic acid-(benzoic ring-13C6), myclobutanil-(phenyl-d4), venlafaxine-d6, (+−)-naproxen-(methoxy-13C, d3)은 Sigma Aldrich (St Louis, MO, USA)에서 구입하였으며, caffeine-13C3, diclofenac-13C6, losartan-d4는 Toronto research chemicals (North York, Ontario, Canada)에서 구입하였다. 실험에 사용된 용매는 모두 HPLC 등급이었으며 acetonitrile, ethyl acetate, methanol은 Fisher scientific (Pittsburgh, USA)에서 구입하였고 증류수는 J.T. Baker (USA)에서 구입하였다. Acetic acid (0.1 M)와 formic acid (100%)은 Fluka chemicals (Buchs, Switzerland)제품을 사용하였고, ammonia solution (20-22%)은 Fisher scientific (Pittsburgh, USA)에서 구입하였다. 표준용액은 처음 시약을 구매한 후, 에탄올을 용매로 하여 1,000 mg/L의 농도로 제조하고 이후 실험의 용도에 따라 메탄올에 희석하여 100, 10, 1 mg/L 등의 농도로 사용하였으며 −20°C에 보관하였다.
2.3. 실험 생물 및 노출실험
노출실험을 위한 생물종은 US EPA, OECD에서 생태 독성 시험을 위해 사용되는 송사리 (Oryzias latipes)를 선정하였으며, 실험실에서 사육한 6~9개월 연령의 성어를 사용하였다.
총 24마리의 송사리가 노출실험에 사용되었으며, 대조군을 포함한 12개 비커에 각각 두 마리의 송사리를 옮긴 후 11종의 대상물질에 대해 200 μg/L의 농도(nominal concentration)를 맞추어 노출실험을 진행하였다. 실험이 진행되는 동안 송사리는 24 ± 2°C의 온도 및 16시간/8시간의 명/암 조건이 유지되는 인큐베이터에 보관되었다. 먹이의 섭취로 인해 받게 되는 영향을 피하기 위해 실험 중에는 먹이를 공급하지 않았다. 노출실험은 96시간동안 진행되었으며 실험 시작 후 48시간 후 1차 시료(노출용액 2 mL 및 송사리 1개체)를 수집하고, 이후 노출 96시간에 2차 시료 수집이 이루어졌다. 초기 노출농도 측정을 위해 실험 시작 직후에도 노출용액을 수집하였다. 수집된 송사리는 전처리를 위해 표면의 물기를 티슈로 제거한 후 conical tube에 담아 무게를 측정하였고, 그 범위는 0.3 − 0.4 g (wet weight)이었다.
2.4. 송사리 내 의약품 농축 및 대사체 예측
실험 대상 물질의 송사리 내 농축에 대한 평가는 식 (1)을 사용한 BCF (bioconcentration factor)의 계산을 통해 예측되었으며, C는 생물체 내에 존재하는 화학물질의 농도(μg/kg)이며, Cw는 노출 용액 내에 존재하는 화학물질의 농도(μg/L)를 나타낸다.
대사체 예측은 LC-HRMS 분석 전 표적 물질에 대한 대사체 관련 문헌 조사 및 in-silico 예측기법을 사용하였으며, in-silico 기법은 미생물의 대사반응을 예측하여 제시한 database인 EAWAG-BBD Pathway Prediction System (EAWAG, Switzerland)을 기반으로 수행되었다. 이를 통해 수집된 예상 대사체의 exact mass를 목록화하여 추정분석을 위한 inclusion list(총 2,434개 물질)에 포함시켰고, DDF (data-dependent fragmentation)을 통한 MS/MS 정보획득에 활용하였다.
2.5. 시료 전처리
노출용액의 전처리는 고체상 추출법 (Solid-phase extraction, SPE)에 의해 이루어졌으며 네 종류의 흡착물질 Oasis HLB (Waters, USA) 200 mg, Isolute ENV+(Biotage, Sweden) 150 mg, Strata X-AW (Phenomenex, USA)와 Strata X-CW (Phenomenex, USA) 각 100 mg으로 이루어진 다층 구조의 카트리지를 사용하였다. 노출실험을 통해 수집된 2 mL의 노출용액에는 8 mL의 증류수를 채워 부피를 10 mL로 맞춘 후 100 ng의 내부표준물질을 첨가하였다. 이후 5 mL의 메탄올과 10 mL의 증류수를 SPE 카트리지에 흘려주어 conditioning한 후 10 mL/min의 속도로 시료를 loading하였고 이과정을 마친 카트리지는 질소가스를 이용하여 건조되었다. 이후 6 mL의 alkaline solution (ethyl acetate/methanol 1:1 v/v with 0.5% ammonia solution)과 3 mL의 acidic solution (ethyl acetate/methanol 1:1 v/v with 1.7% formic acid)을 이용하여 용출(elution)하고, 질소로 농축하였다. 농축된 용액에 water/methanol (9:1, v/v) 용액을 주입하여 최종 부피를 1 mL로 맞추어 vortexing하고 0.2 μm cellulose acetate filter (ADVANTEC, Tokyo, Japan)를 사용하여 여과한 후 분석용 vial에 옮겨 기기분석 전까지 4°C에 보관하였다.
생물시료의 전처리를 위해서 수집된 송사리가 담긴 conical tube에 5 mL의 methanol과 내부표준물질 100 ng을 첨가하여 homogenizer (Daihan Scientific, South Korea)로 시료를 균질화하고 원심분리한 후 분리된 층의 상등액을 회수하였다. 이후 상등액은 0.2 μm cellulose acetate filter (ADVANTEC, Tokyo, Japan)를 사용하여 부유물을 걸러주었으며 걸러진 추출물은 질소 농축기를 이용하여 농축시켰다. 농축액은 water/methanol (9:1, v/v) 용액 1 mL로 재구성하고 0.2 μm cellulose acetate filter (ADVANTEC, Tokyo, Japan)로 여과한 후 분석용 vial에 옮겨 기기분석 전까지 4°C에 보관되었다.
2.6. 기기분석
실험대상물질 및 대사체에 대한 표적/추정/비표적분석을 위해 Ultimate 3000 ultra-high performance liquid chromatography (Thermo Fisher Scientific, San Jose, CA, USA)에 Q Exactive Plus Orbitrap mass spectrometry (Thermo Fisher Scientific, San Jose, CA, USA)를 연동하여 사용하였다. 물질 분리를 위한 column은 Xbridge C18 (2.1 × 50 mm, 3.5 μm, Waters, USA), 이동상 용매는 (A) water with 0.1% formic acid (B) methanol with 0.1% formic acid가 사용되었다. 총 29분의 분석 시간동안 이동상의 조성은 용매 (B)의 비율을 분석 시작 시점에서 10%로 흘려주어 초기 4분간 50%까지 높인 다음, 17분까지 95%로 증가시켜 8분간 동일한 상태로 유지한 후 25분이 되는 시점에서 10%로 감소시켜 분석이 끝날 때까지 평형으로 유지시켜 주었다. 이동상의 유속은 0.2 mL/min이었으며, 주입된 시료의 양은 10 μl이었다. 질량분석의 이온화는 ESI (electrospray ionization) 방식으로 이루어졌으며 두 가지 이온화 모드(positive, negative)에서 분석되었다. Capillary 온도와 spray voltage는 320°C 및 positive mode, negative mode에서 각각 3.8 kV, 3.0 kV로 설정하였다. Column oven의 온도는 35°C로 맞춰주었다.
2.7. 분석데이터 처리
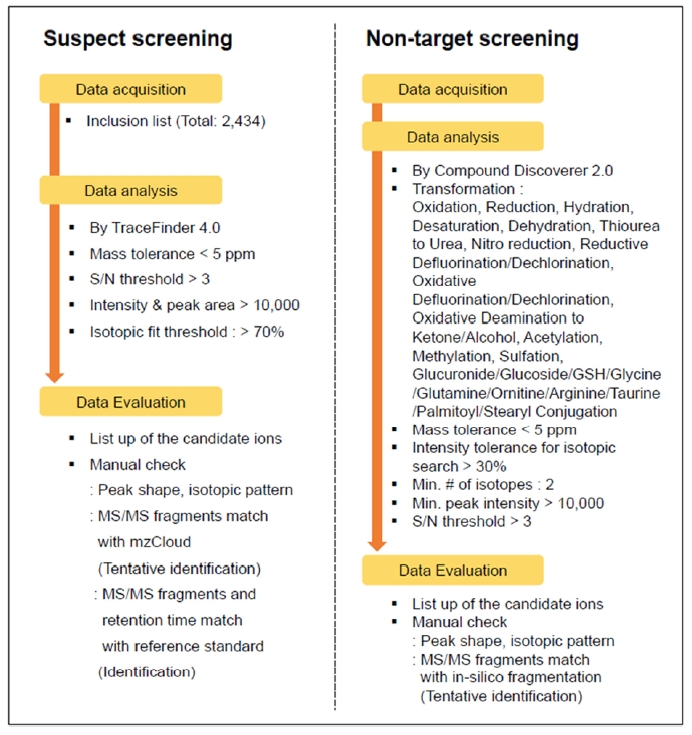
표적 기법(target screening)을 통한 분석대상물질의 정량 및 추정 기법(suspect screening)을 통한 예측된 대사체의 검출 확인을 위해, TraceFinder 4.0 (Thermo Fisher Scientific, USA)을 사용하였다. 정량분석을 위해 내부표준법(isotope dilution method)을 사용하였다. 추정기법을 위한 데이터처리 과정은 다음과 같다(Fig. 1). 분석을 통해 얻어진 full scan 데이터를 대상으로 mass tolerance threshold < 5 ppm, signal to noise (S/N) threshold > 3, ion intensity and peak area threshold > 1E4, isotopic fit threshold > 70% 조건을 설정하여 얻어진 유효한 peak의 m/z 정보를 선별하였다. 이후 manual check를 실시하였으며, 이는 peak shape, isotopic pattern, MS/MS fragments match 확인을 통해 이루어졌다. 마지막 단계로, mzCloud와 같은 mass spectral library와 비교하여 tentative identification 결과와 tentative identi-fication 이후 실제 reference standard를 분석한 데이터와 비교하여 identification 결과를 확인하였다.
비표적 기법(non-target screening)을 통한 대사체 확인을 위해서는 Compound Discoverer 2.0 (Thermo Fisher Scientific, USA)를 사용하였으며, 생물 체내에서 발생할 수 있는 phase 1, phase 2 대사를 고려하여 분자식을 예측하였다. 이를 위해 고려된 대사기작은 oxidation, reduction, hydration, desaturation, dehydration, thiourea to urea, nitro reduction, reductive defluorination/dechlorination, oxidative defluorination/dechlorination, oxidative deamination to ketone/alcohol, acetylation, methylation, sulfation, glucuronide/glucoside/GSH/glycine/glutamine/ornitine/arginine/taurine/palmitoyl/stearyl conjugation이었다. 유효한 peak의 선별을 위해 사용된 설정값은 mass tolerance < 5 ppm, intensity tolerance for isotopic search > 30%, Minimum number of isotopes:2, Minimum peak intensity > 10,000, S/N threshold > 3이었다.
2.8. 검출 물질의 신뢰도
추정/비표적 기법을 통해 검출된 물질은 isotopic pattern을 확인한 후 표준물질 혹은 MS/MS spectral database와의 비교와 해석을 통해 검증되는데, 이 경우 분석된 데이터로 확인가능한 정보의 양에 따라 검출된 물질에 대한 신뢰도를 평가하게 된다[13]. 이는 검출된 물질과 동일한 표준물질이 존재하는 경우, 표준물질의 분석을 통해 물질의 RT 및 MS/MS의 비교를 하여 검증하게 되며, 이를 만족하는 경우 신뢰도 등급 1을 부여하게 된다. 다음으로 표준물질의 구비가 불가능한 경우 mass spectral database (e.g., mzCloud, MassBank)와의 비교를 통해 확인하게 되는데, 이렇게 확인된 물질에는 신뢰도 등급 2를 부여하게 된다. 또는 비교 가능한 MS/MS spectrum 정보가 없는 경우, 검출된 물질의 예상 구조로부터 생성될 수 있는 MS/MS 정보와 실제 분석된 시료의 MS/MS spectrum의 비교를 통해 그 결과가 일치하면 신뢰도 등급 3을 부여하게 된다. 설명된 세가지 과정에 해당하지 않는 검출물질은 대사체의 후보로서 신뢰도 등급 4이하로 구분하였다.
3. 결과 및 고찰
3.1. QA/QC 및 정량 결과
실험 대상 물질 11종의 정량분석에 대한 QA/QC 결과를 Table 1에 표시하였다. 분석 물질의 검출한계(limit of detection, LOD) 및 정량한계(limit of quantification, LOQ)의 결정은 표준물질을 분석한 데이터의 크로마토그램에서 검출된 피크의 S/N 비(signal to ratio)의 값이 3이상인 경우의 가장 낮은 농도 값을 LOD로, 10 이상인 경우의 가장 낮은 농도 값을 LOQ로 하였다. 본 연구에 사용된 11종의 실험 물질의 LOD는 0.1 ng/L, LOQ는 0.1~10 ng/L이었다. 분석 물질의 정확도 및 정밀도의 측정은 노출 용액 및 송사리 각각에 대해 해당 시료의 전처리법과 동일하게 수행되었다. 이에 따라 분석 대상 시료의 matrix effect에 대한 분석 물질의 회수율(relative recovery)을 측정하였으며, 그 범위는 노출용액에서 57~86%, 송사리에서 69~143%이었다. 분석 대상 물질 개별의 check standard를 3회 분석하여 상대 표준 편차(relative standard deviation, RSD)의 계산을 통해 구해졌고, 그 결과 노출 용액에서 0.3~2.3%, 송사리에서 0.8~13.7%이었다.
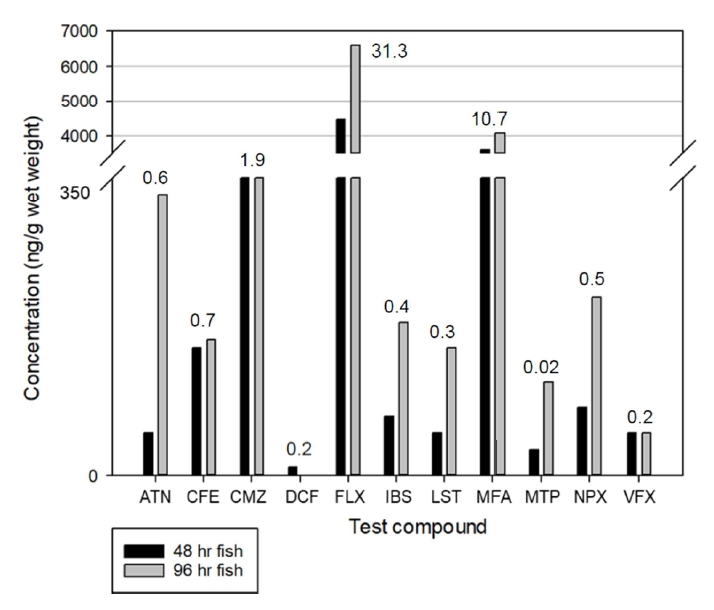
노출실험을 통해 얻어진 송사리 시료는 대상물질의 농축 확인을 위해 분석되었다. 96시간의 노출기간 동안 DCF에 노출된 송사리 한 마리가 48시간 샘플링 이후에 사망하였고, 그 이외의 23개체가 분석에 사용되었다. 정량분석 결과 및 계산된 BCF 등의 분석결과를 Fig. 2에 표시하였다. 그 결과, DCF을 제외한 모든 시료에서 96시간 시료에서 측정된 실험 물질의 농도가 48시간 시료에서 측정된 것보다 같거나 높은 것으로 확인되었다. 그 중 CMZ, FLX, MFA에 노출된 송사리에서의 BCF는 1.9, 31.3, 10.7로 계산되어 체내 농축정도는 크지 않은 것으로 평가되었다. Oreochromis niloticus에 대한 CFE의 약물동태학 연구에서는 혈장, 간, 아가미에서 체내에 유입된 CFE의 빠른 제거율을 보였다[14]. 이를 통해 시간에 따라 체내에 농축된 물질의 농도가 비슷한 경우는 해당 물질의 체내 반감기가 짧을 것으로 예상한다. CMZ의 경우, Pimephales notatus, Ictalurus punctatus, Oreochromis niloticus에 대해 그 축적성이 평가된 사례가 있으며, 실제 환경 및 lab scale 실험에서 대상 물질이 축적되는 정도가 유사한 것이 확인되었다[15]. 실제로, CMZ은 하천에서 서식한 수생물의 장기에서 잠재적인 축적성을 보인 바가 있다[16]. FLX은 Oryzias latipes의 몸 및 간에서 그 축적성이 조사된 바 있으며, 간에 축적된 CMZ의 농도가 전체 몸에 대해 측정된 농도보다 높았다[17]. CMZ 연구대상종에 대한 장기별 축적 연구에서는 CMZ이 아가미, 장, 간, 뇌, 근육 등의 여러 장기에서 다양한 농도로 나타나는 것을 확인하였으며, 그 중에서도 간과 뇌에 높은 축적도를 보였다. 본 연구에서는 분석을 위해 whole body를 사용하였기 때문에 간, 뇌 등에 고농도로 축적된 물질이 다른 장기에 의해 희석되었을 것으로 추정된다[18].
3.2. 송사리 내 의약품 대사체
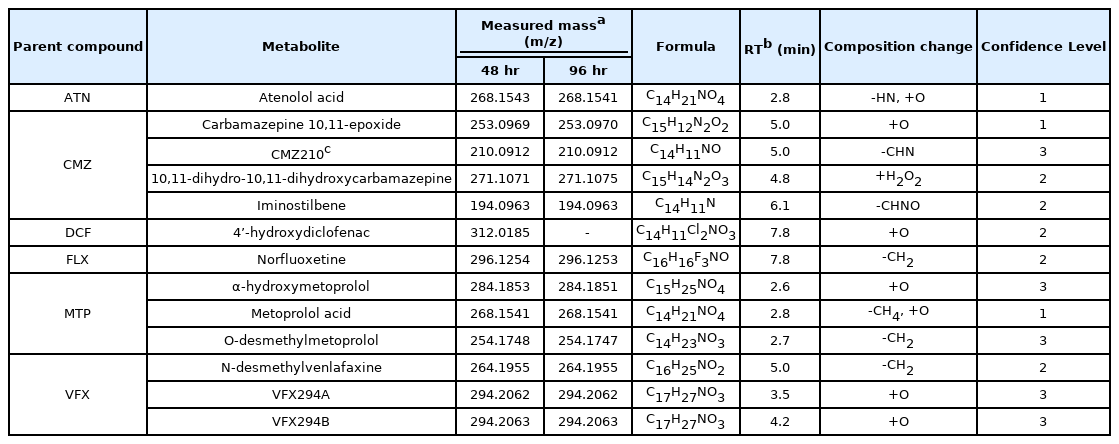
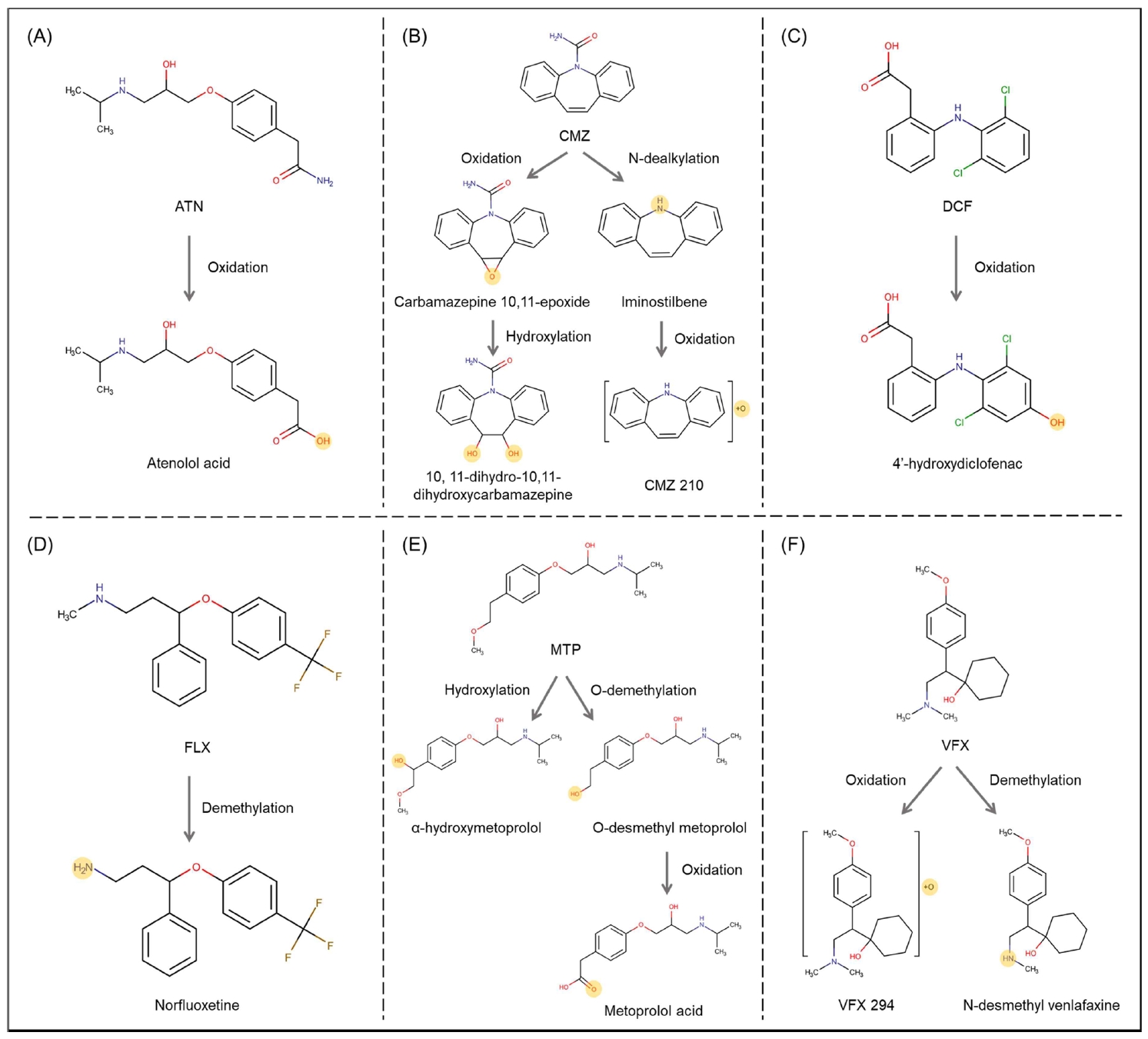
추정/비표적 기법을 통한 분석 결과로 6개 실험 물질에서 13개의 의약품 대사체가 검출되었다(Table 2). 이 중에서 추정 기법을 통해 확인된 대사체는 12종이었고, 비표적 기법을 통해 확인된 대사체는 1종이었다. 검출된 대사체로는 ATN에서 atenolol acid, CMZ에서 carbamazepine 10,11-epoxide, 10,11-dihydro-10,11-dihydroxycarbamazepine, iminostilbene, DCF에서 4’-hydroxydiclofenac, FLX에서 norfluoxetine, MTP에서 α-hydroxymetoprolol, metoprolol acid, O-demethyl metoprolol, VFX에서 N-desmethyl venlafaxine, VFX294A, VFX294B이었다. 비표적 기법으로는 CMZ에서 CMZ210이 검출되었다. 모화합물로부터 검출된 대사체의 분자구조는 Fig. 3에 나타내었다.

Chromatogram of detected metabolites for carbamazepine and their MS/MS fragment. (A) Confirmation matching with reference standard; (B) Structure elucidation with MS/MS fragment interpretation; (C) Comparison of MS/MS fragment with mzCloud database.
ATN의 대사체인 atenolol acid는 표준물질을 통해 확인되었으며, 이는 ATN의 구조 중 아민기(amine group)가 이탈된 지점에 산소가 결합하여 형성된 물질이다. 이는 미생물을 이용한 ATN 생분해 실험에서도 같은 대사체가 확인되었다[19]. 노출 시간별 peak area는 96시간 시료에서 48시간 시료에서 검출된 것보다 약 200배 정도 높은 수치를 보였는데, 이는 ATN으로부터 atenolol acid로의 변환속도가 시간에 따라 달라질 수 있음을 암시하였다.
Carbamazepine 10,11-epoxide는 48시간 및 96시간 시료에서 모두 검출되었으며 이는 표준물질을 통해 확인되었다. Carbamazepine 10,11-epoxide는 CMZ에서 산소가 결합된 물질이며 산소 원자가 같은 물질 내 2개의 탄소와 결합하여 생성된다. 이 물질의 peak area는 모화합물인 CMZ의 peak area와 비슷한 수준으로 관찰되었으며, 96시간 수집 시료의 peak area가 48시간에서 보다 약 2배 높았다. 또한 이 물질은 CMZ의 대사체 연구를 위한 유사한 실험에서도 Solea senegalensis의 담즙 및 Mytilus galloprovincialis의 근육에서 발견된 바 있다[20,21]. 10, 11-dihydro-10,11-dihydroxycarbamazepine은 mass spectral database인 mzCloud와의 비교 분석을 통해 확인되었으며 CMZ을 Mytilus galloprovindialis에 노출시켜 확인한 대사체의 결과와 일치하였다[21]. 노출시간에 따른 peak area는 96시간 시료에서 관찰된 값이 48시간 시료에서 확인된 결과보다 약 10배 높게 나타났다. CMZ 210은 비표적 기법을 통해 확인되었으며, 표준물질 및 mass spectral database와 같은 비교가능한 정보가 없어 MS/MS fragment의 해석으로 분자구조가 예측되었다. 이 물질은 CMZ에서 질소 부분에 결합되어 있는 acetamide 그룹이 떨어진 구조에 산소가 결합하여 형성된 것으로 추정되나, 산소결합 위치가 불명확하여 보다 구체적인 분자구조를 제시할 수 없었다.
DCF의 대사체로는 4’-hydroxydiclofenac이 확인되었으며 이는 mzCloud database를 통해 비교분석되었다. 기존 Oncorhynchus mykiss를 사용한 실험에서도 동일한 대사체가 관찰된 바 있다[22]. 해당 물질에 대한 본 연구의 노출실험에서 48시간 이후 송사리가 사망하여, 노출시간에 따른 비교는 할 수 없었다.
FLX의 대사체로는 norfluoxetine이 발견되었으며 이는 mzCloud database와의 비교분석을 통해 확인되었다. Norfluoxetine은 FLX의 대표적인 대사체로 알려져 있다[23]. 모화합물인 FLX의 구조 중 methyl group이 분리되면서 형성된 물질이며 96시간째 시료에서의 peak area가 48시간째 시료에서의 값 보다 약 7배 정도 높은 값을 나타내었다. 이러한 시간에 따른 양적 변화는 FLX이 수생 생물에 흡수되는 속도보다 norfluoxetine의 형성률이 높다고 보고된 연구 결과와 일치한다[23]. Ameiurus nebulosus, Dorosoma cepedianum, Morone americana에 대한 연구에서도 norfluoxetine은 모화합물인 FLX과 비슷하거나 높은 수준으로 검출되는 것이 확인되었다[24].
MTP의 대사체로 검출된 3종 중 α-hydroxymetoprolol은 MS/MS의 해석을 통해 확인되었다. 이 물질은 MTP에 산소가 결합하여 형성된 물질이며, 시간에 따른 peak area는 비슷한 수준으로 확인되어 변화는 없었다. Metoprolol acid는 표준물질을 통해 확인되었으며, MTP에서 메틸기가 떨어지고 산소가 결합하면서 카르복실기를 형성하는 분자구조를 가진다. O-desmethyl metoprolol은 MS/MS의 해석을 통해 확인되었으며, 모화합물인 MTP의 메틸기가 떨어지면서 형성된 것으로 예상된다.
VFX의 대사체로는 N-desmethyl venlafaxine, VFX294A, VFX294B가 검출되었다. N-desmethyl venlafaxine은 mzCloud와의 비교를 통해 확인되었다. 노출 시간에 따른 peak area의 변화는, 대부분의 다른 대사체의 변화 양상과는 달리, 96시간 시료에서의 peak area가 48시간 시료의 0.2배로, 시간이 지남에 따라 감소한 것을 확인하였다. VFX294A 및 VFX294B는 같은 분자식을 가지지만 같은 다른 RT에서 관찰되었기 때문에 구조 이성질체로 판단된다. 해당 대사체들은 모화합물인 VFX에 산소가 결합하여 형성된 것으로 예상되며, MS/MS의 해석을 통해 확인이 이루어졌으나 산소가 결합된 정확한 위치는 확인할 수 없었다.
3.3. 대사체 형성 반응
본 연구에서 확인된 모화합물에 따른 대사체 형성에 관여한 반응으로는 총 12건의 반응 중 oxidation 6건, demethylation 3건, hydroxylation 2건, dealkylation 1건이 확인되었으며, 이를 통해 예측된 대사경로를 Fig. 4에 나타내었다. Oxidation에 의해 생성된 대사체는 atenolol acid, carbamazepine 10,11-epoxide, CMZ 210, 4'-hydroxydiclofenac, metoprolol acid, VFX 294이었으며, 생체변환 경로 중 가장 주요한 대사경로이기 때문에 관찰된 대사 반응 중 가장 빈번하게 발생한 것으로 나타났다[25]. Demethylation을 통해서는 norfluoxetine, O-desmethyl metoprolol, N-desmethyl venlafaxine이 생성되었다. Hydroxylation에 의해 생성된 대사체로는 10,11-dihydro-10,11-dihydroxycarbamazepine, α-hydroxymetoprolol이 있으며, 대사체 iminostilbene은 dealkylation에 의해 생성되었다. 이러한 대사반응 중 oxidation, hydroxylation은 phase I reaction에 해당하며, phase I reaction 이후에 phase II reaction이 발생하면 GSH conjugation, cysteine, sulfate conjugation 등의 반응이 관여하여 추가적인 대사체 확인이 가능할 것으로 예상된다[26].
4. 결 론
본 연구에서는 국내 수계에서 상대적으로 높은 농도로 빈번하게 출현하는 의약품 11종(ATN, CFE, CMZ, DCF, FLX, IBS, LST, MFA, MTP, NPX, VFX)을 대상으로 송사리(Oryzias latipes)에서의 생물농축 및 생체변환을 확인하였다. 그 결과로 CMZ, FLX, MFA는 BCF1.9, 31.3, 10.7을 보이며 송사리 체내에 농축되는 것을 예상할 수 있었다. 총 12종의 대사체가 확인되었으며, oxidation, demethylation, hydroxylation, dealkylation의 대사반응을 통하여 대부분의 대사체가 생성이 되는 것을 확인하였고 모화합물로부터 생성 가능한 대사체의 분자구조를 제시하였다. 이는 추후 모화합물 대비 대사체의 독성 변화를 평가하는데 활용이 가능할 것으로 기대된다.
Acknowledgements
이 논문은 2019학년도 창원대학교 연구교수 연구비에 의하여 연구되었음.