1. 서 론
나노 기술의 급격한 발전과 수요 증가는 의학, 미용, 촉매, 의류, 자동차, 에너지, 전자 장비 등의 다양하고 광범위한 산업 분야에서 금속 산화 나노 입자가 적용되고 있다[1,2]. 전 세계적으로 금속산화 나노입자는 2012년 기준 0.27만톤만이 생산되었지만, 2020년에는 166만톤까지 생산량이 약 613배 이상 증가한 상황이다[3]. 급격한 생산량의 증가는 필연적으로 금속 산화 나노 입자가 다양한 경로로 환경 노출을 발생시키고 있으며 최근 연구 결과 전체 생산량의 8-28%는 토양에서, 0.4~7%는 수계에서, 0.1~1.5%는 대기에서 검출되었다[4].
금속산화 나노입자의 과도한 사용량 증가는 환경으로의 유입 역시 급격히 증가시키고 있기 때문에 그에 따라 다양한 환경 문제가 발생되고 있다[5,6]. 아연산화 나노입자 (ZnO NP)는 전세계적으로 가장 많이 사용되는 나노입자들 중 하나이며, 촉매, 반도체, 센서, 썬크림, 화장품, 코팅 및 광학 기기 등의 다양한 범위에 활용된다. ZnO NP는 나노입자로서의 독성과 해리된 Zn2+에 의해 독성이 발현될 수 있으며, 해리, 황화, 인산화 그리고 유기물과의 결합을 통하여 변형되어 다른 형태로 독성이 발현된다[7]. 따라서 환경 변화에 따른 ZnO NP의 구조 변환을 이해하는 것은 매우 중요하다.
특히 ZnO NP가 지표수나 하수에 유입되면 정수나 하수 처리 시설의 다양한 처리 환경에 노출되고, 그 결과에 따라 응집, 결정 성장, 비반응성 구조로 변형 혹은 흡착 등을 통하여 안정성이 높은 구조로 변화될 수 있다[8]. 그와 반대로 해리, 입자 분리, 반응성이 높은 구조로의 변형 그리고 탈착 등을 통하여 안정성이 낮은 구조로 변화하여 생태계에 독성을 발현할 수 있다[9]. 이렇게 다양한 경로로 유입되는 ZnO NP와 Zn2+ 이온은 환경 시스템 내에 축적되어 독성을 발현함으로써 동·식물과 인간의 생명을 위협할 수 있기 때문에[10,11], 금속산화 나노 입자에 대한 물리화학적 특성 평가와 동시에 이들이 변형되면서 일어날 수 있는 환경문제에 대한 연구가 필수적이다.
따라서 본 연구는 하수 처리 과정에서 발생하는 pH와 이온 강도 변화, 탄산염 그리고 황화물 풍부 조건이 ZnO NP의 구조 변환에 미치는 영향을 다양한 분석 장비를 이용하여 형태와 구조적인 특성을 확인하고, 이러한 결과를 바탕으로 하수 처리 과정 중에서 ZnO NP의 변환을 해석하고 환경 내 거동을 예측하는 것이 목표이다.
2. 재료 및 방법
2.1. 배치 실험
하수 처리 과정을 모사하기 위하여 인공 하수를 합성후 사용하였으며(10 mM C3H5NaO3, 0.1 mM ascorbic acid, 1 mM NH4Cl, 0.2 mM K2HPO4, 0.01 mM MgSO4, 0.5 mM Na2SO4, 0.1 mM FeCl2, 1 μM CaCl2, 0.5 mM NaHCO3 and 10 mg L-1 yeast extract), 1 L의 Duran bottle에 1 L의 인공 하수와 Sigma-Aldrich(USA)에서 구매 한 ZnO NP(#677450)를 500 mg을 투입 후 5개의 처리를 하였다. 아무 것도 처리하지 않는 호기성 대조군 (control for sewage under oxic, CSO), 혐기성 대조군(control for sewage under anoxic, CSA), 탄산염이 풍부한 호기성 조건(sewage with carbonate under oxic, SCO), 탄산염이 풍부한 혐기성 조건(sewage with carbonate under anoxic, SCA) 그리고 황화물이 풍부한 혐기성 조건(sewage with sulfide under anoxic, SSA)을 설정하였다. 탄산염과 황화물은 10 mM 농도로 NaHCO3와 Na2S를 추가 투입하였다. 호기성 환경을 조성하기 위해 산소를, 혐기성 환경을 위해서는 질소를 0.5 L min-1로 폭기 하였다. 미생물의 영향을 배제하기 위하여 배치 실험을 수행하기 전에 고압멸균기를 사용하여 멸균하였으며, 투입된 ZnO의 농도는 미생물에 독성을 유발하는 농도이기 때문에 미생물에 대한 영향을 배제하도록 하였다. 배치 실험 중 0, 3, 48, 96 그리고 168시간에 시료를 채취하여 수소이온농도(pH), 전기전도도(EC), 산화환원전위(ORP) 그리고 용존산소(DO)를 측정하였으며, 형태와 구조에 대한 세부적인 분석을 실시하였다.
2.2. 입도 및 성분 분석
입도 분석을 위하여 두가지 분석 방법을 사용하였는데, 첫번째는 동적광산란(dynamic light scattering, DLS)기법에 기반한 Zetasizer Nano Zs(Malvern, UK) 장비를 이용한 콜로이드 상태로의 측정 방법과, 투과전자현미경(transmission electron microscopy, TEM) 분석을 Cs-corrected JEM-ARM200F(Jeol, Japan)을 사용하여 건조 상태의 측정을 실시하였다. DLS 분석을 위하여 배치 실험 과정 중에서 주사기를 이용하여 시간 별로 시료를 채취 후 DLS 분석하였고, zeta potential도 동일한 기기를 사용하여 측정하였다. TEM 분석을 위해 주사기를 이용하여 시간 별로 시료 채취 후 8,000 rpm 조건으로 10분간 원심분리 후 여액을 버리고, 3차 증류수로 시료를 세척하였다. 이후 각각 조건에 따라 산소 혹은 질소로 폭기되는 건조기에서 카본 필름으로 코팅된 구리 TEM grid에 올려 건조 뒤 TEM 분석을 실시하였다. 또한 TEM 분석 과정에서Energy dispersive spectrometer(Bruker, Germany)를 이용하여 성분 분석을 실시하였다[12].
2.3. 결정 및 결합 구조 분석
결정 구조 분석을 위하여 TEM, X선 회절 분석(X-ray diffractometer, XRD)를 수행하였고, 결합 구조 분석을 위하여 X-선 광전자 분광법(X-ray absorption spectroscopy, XPS)을 이용하여 분석을 실시하였다. 배치 실험 후 시료를 채취하여 8,000 rpm으로 20분간 원심 분리한 뒤 여액을 제거하고 3차 증류수로 세척하였다. 세척 후 다시 원심분리하여 여액을 제거한 뒤 산소 및 질소를 폭기하여 건조하였다. 완전히 건조된 시료를 막자 사발을 사용하여 분쇄하여 만든 파우더 형태의 시료를 XRD 분석하였고, 12,000 kg cm-2의 압력을 가해 준비한 펠렛 형태의 시료로 XPS 분석을 수행하였다. TEM으로 측정된 이미지를 Micrograph 소프트웨어(Gatan, USA)를 이용하여 selected area electron diffraction(SAED)패턴을 추출하였고, 이를 바탕으로 d-spacing을 계산하였다. XRD는 X'Pert Pro (PANalytical, Netherland)를 이용하여 CuKα radiation (λ = 0.15418 nm) 조건에서 2-Theta를 5-90도로 설정하여 분석하였다. 측정된 스펙트럼은 American mineralogist crystal structure database에 저장되어 있는 결정구조들과 비교하여 결정 구조를 해석하였다[13]. 결합 구조를 측정하기 위하여 VG multilab 2000 (Thermo, USA)를 사용하였다.
3. 결과 및 고찰
3.1. 산화 아연 나노입자의 물리화학적 특성
본 연구에서 사용된 ZnO NP(분자량: 81.39 g mol-1)은 알루미늄(Al)이 6%의 비율로 도핑되어 있으며, 50 nm이하(TEM 분석)의 크기와 108 m2 g-1의(N2-BET 분석) 비표면적을 가진다고 보증되었다. TEM으로 확인한 ZnO NP의 형태는 구형으로 확인되었으며, 무작위로 150개의 입자를 측정하여 평균을 계산한 결과 24.7 ± 3.1 nm로 측정되었다. DLS 분석 결과 Z-average는 216 nm로 측정되었으며, 이는 DLS가 hydrodynamic 크기를 나타내기 때문이고, 본 결과는 이전 연구에서 보고된 것과 유의미한 차이를 나타내지 않았다. SAED 분석 결과 회절패턴으로부터의 거리는 3.52 1/nm와 4.14 1/nm으로 나타났으며, 이것은 역수가 d-spacing이 동일하므로 각각의 역수를 구하면 2.83 Å과 0.241 Å으로 Zincite 결정 구조의 (001)면과 (100)면이 동일하기 때문에 ZnO NP로 확인하였다. XRD 분석 결과 31.78°, 34.43°, 36.26°, 47.54°, 56.58°, 62.84°, 66.37°, 67.96°, 69.19°, 72.58°, 76.88°에서 회절이 관찰되었으며, 이들은 각각 Zincite의 (100), (002), (101), (102), (110), (103), (200), (112), (201), (004), (202)면으로 indexing되었다. TEM-EDS결과 O, Cu, C, Zn, Al 원소들이 검출되었으며, O와 Zn은 ZnO결합에 기인한 것이며, Cu는 시편을 제작할 때 copper grid를 이용하였기 때문이다. C의 경우에도 시편 그리드가 carbon film으로 코팅되어 있어 나타난 결과이며, Al은 본 연구에서 사용하는 ZnO NP이 Al 6%로 도핑되어 있었기 때문에 나타난 결과로 보인다.
3.2. 배치 실험에 따른 환경 변화와 입자 크기 변화
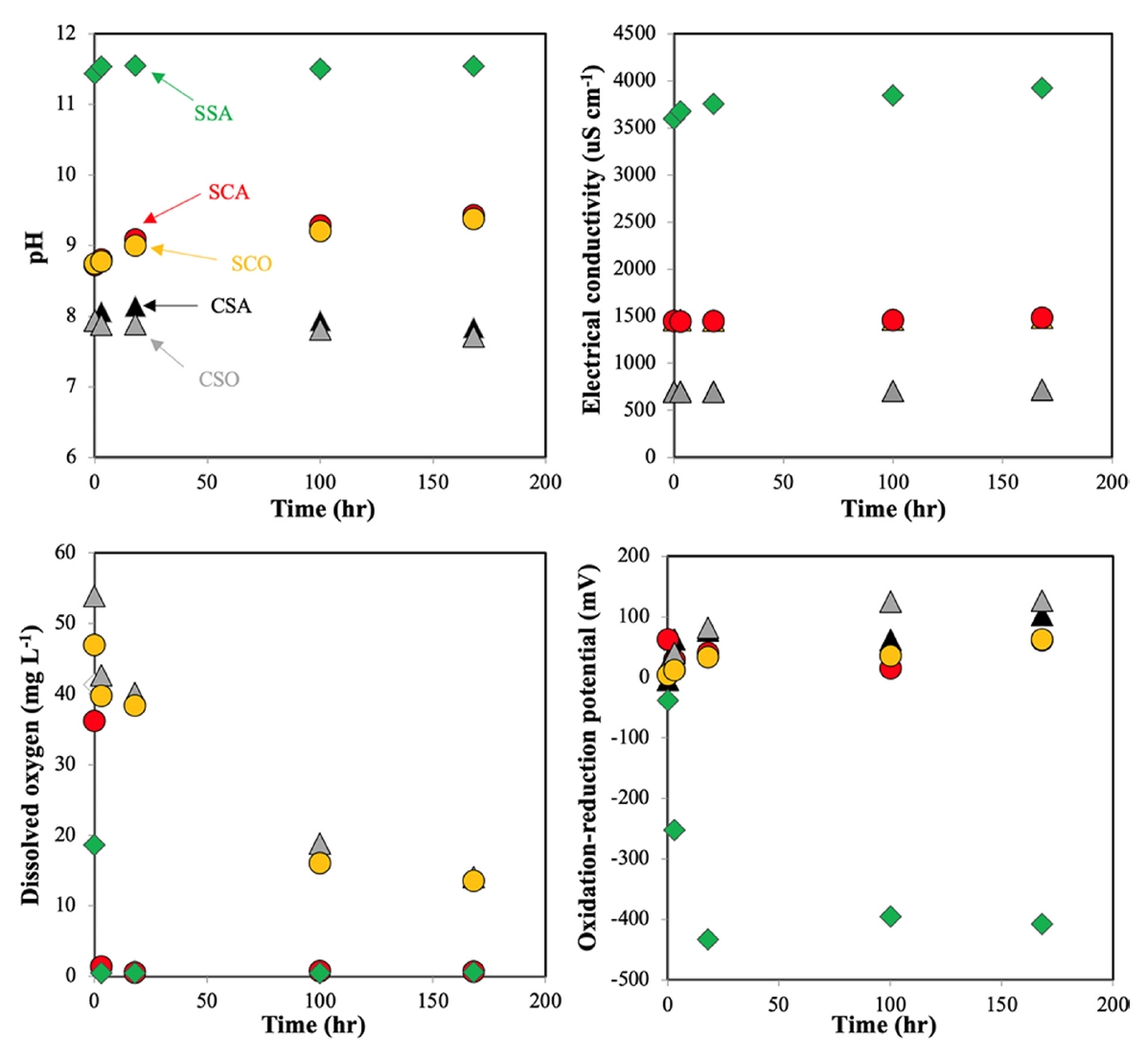
Fig. 1은 168 시간의 배치 실험 동안에 pH, EC, DO 그리고 ORP를 나타낸 그림이다. 분석 결과 황화물 처리에서 pH가 가장 높게 나타났고, 그 다음 탄산염 처리(SCO와 SCA) 그리고 두 대조군(CSO와 CSA)에서 pH가 가장 낮은 것으로 나타났다. 호기 조건에 따라서 pH 변화는 큰 차이를 나타나지 않았으며, 탄산염 처리의 경우 시간 경과에 따라 증가되는 패턴을, 대조군에서는 감소되는 패턴이 관찰되었다. EC 역시도 호기 조건에 따라 차이가 발생되지 않았으며, 시간에 따른 증감도 나타나지 않았다. 다만 SSA 처리에서 시간의 증가에 따라 EC가 증가되는 것이 확인되었는데 이는 Zn2+ 이온이 해리되는 가능성을 제시한다. DO의 경우 산소 조건에 따라 큰 차이가 발생되었으며, 폭기가 지속됨에도 불구하고 호기 처리에서도 DO가 감소되었지만, 시간에 따라 일정수준 평행에 도달하는 것으로 예측된다. 다만 혐기성 조건에서는 즉각적으로 DO가 감소되었는데, DO는 0에 가깝게 감소되었고, 증가가 일어나지 않았다. ORP의 경우 SSA 처리에서는 급격한 감소가 나타났지만, 나머지 처리군에서는 증가되는 경향이 나타났다.
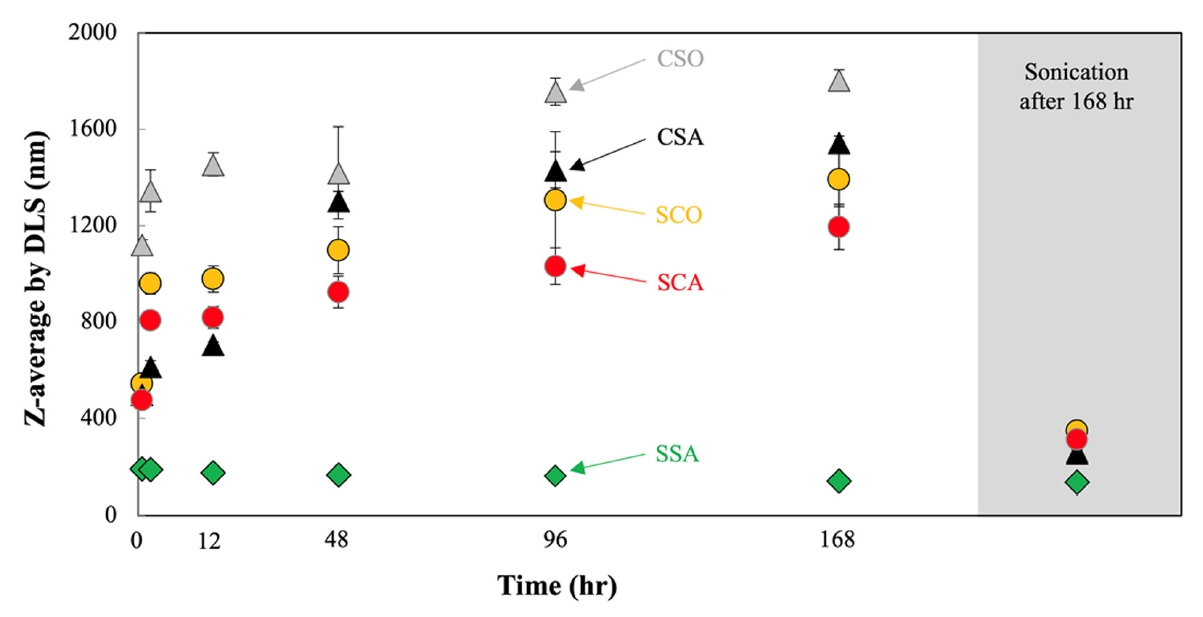
처리군 별 ZnO NP의 Z-average 값 변화를 Fig. 2에서 나타내었다. SSA처리를 제외하고 모든 처리군에서 시간 증가에 따라 Z-average는 증가 경향을 나타내었는데, 이는 입자의 크기가 증가되었음을 의미하고, 호기 조건이 혐기 조건 보다 더 높은 Z-average 값을 가지는 것으로 나타났다. CSO 처리에서 가장 높은 값을 나타내었고, CSA, SCO, SCA 그리고 SSA 순서로 작아지는 것으로 측정되었다. 168시간 경과 후 CSO와 CSA에서 Z-average 값은 1802와 1544 nm로 나타났으며, 탄산염 처리군인 SCO와 SCA에서는 1391과 1195 nm 그리고 황화물 처리군인 SSA에서는 140 nm로 측정되었다. 168시간 경과 후 sonication을 통하여 ZnO NP를 물리적으로 분리하였을 때 CSO와 CSA는 261과 254 nm로 초기 측정 값인 216 nm와 큰 차이를 나타내지 않았으며, 탄산염 처리인 SCO와 SCA는 각각 349와 312 nm로 나타나면서 크기 증가가 있을 가능성을 나타내었고, SSA 처리의 경우 136 nm로 sonication 후에도 큰 차이가 없는 것으로 나타났다.
이 결과를 바탕으로 시간 증가에 따라 하수에 용해되어 있는 다양한 이온들이 ZnO NP의 표면에 흡착하여 ZnO NP의 zeta potential에 영향을 주게 되고, 그에 따라 ZnO NP이 응집하여 존재한다는 것이 확인되었고, sonication에 의해 쉽게 분리되는 것으로 판단할 때 이는 electrostatic attraction에 의한 것으로 crystal growth나 NP 사이에 강한 공유 결합이 생성되지 않는 것으로 판단된다. 다만 탄산염이 처리되었을 경우 입자크기가 유의미하게 증가하는 것이 확인되는데 이는 Z-average의 경우 hydrodynamic한 크기 이기 때문에 이온 조성에 영향을 받을 수 있으며 실제 TEM을 이용하여 이러한 현상을 다시 규명할 필요가 있다. SSA 처리에서 ZnO NP의 크기는 줄어드는 것으로 분명하게 확인되었고, 이는 SSA 처리가 다른 처리들과 다른 기작이 작용할 수 있다는 것을 의미한다. pH 증가에 따라 입자 크기는 감소되는 경향을 나타내었고, 이는 pH 증가에 따라 표면 전하가 증가되었기 때문으로 추정된다. 선형 회귀 분석 결과 결정계수는 0.5662로 유의성을 나타내었다. 전기전도도 증가에 따라 입자 크기는 감소되는 경향을 나타내었고, 이는 이온 강도 증가에 따라 전기 이중층의 두께가 감소되어 응 집이 일어난다는 기존의 결과와 반대되는 결과를 나타내었다. 이는 전기전도도의 영향 보다 pH 영향에 따라 표면 전하 값이 매우 크기 때문에 입자간 반발력이 더 강해지기 때문으로 추정된다.
3.3. TEM-EDS 분석을 통한 입도, 성분 그리고 결정구조 해석
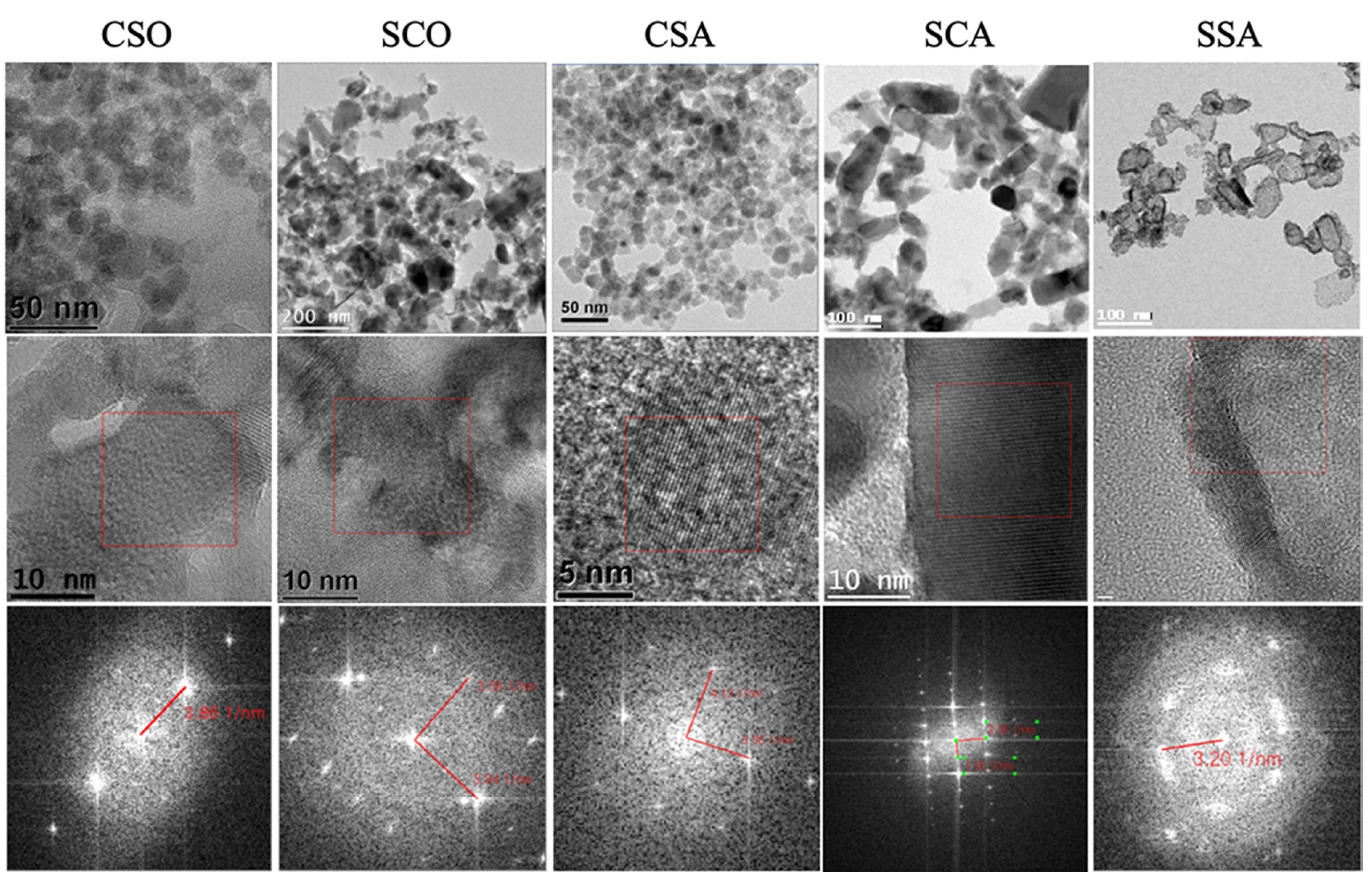
TEM을 이용하여 처리군들을 시간별로 모니터링 하였고, 168시간 후 TEM 이미지들을 정리하여 SAED 패턴과 함께 Fig. 3에 도식화 하였다. TEM을 이용하여 입도 크기 분석 결과 그림에서 나타나 있듯이 CSO와 CSA는 ZnO NP powder 분석 결과와 비슷한 입도 분포를 나타내었지만, 탄산염이 처리된 SCO와 SCA의 경우 기존에 관찰된 구형 입자가 아니라 직사각형 형태의 입자들이 발견되었으며, 이 입자를 SAED 패턴 분석한 결과 기존에 관찰된 ZnO NP와 동일한 d-spacing 값을 가지는 것으로 판단하였기 때문에 직사각형 입자의 경우 구형 ZnO NP가 crystal growth를 통하여 직사각형 형태로 커진 것으로 추정되는데 이는 XRD나 XPS 분석을 통하여 조금 더 심층적인 분석이 이뤄질 필요성이 있다. SSA의 경우 다른 처리군들과 확연히 다른 형태의 NP가 관찰되었는데, 이는 10 nm 이하의 구형 입자들이 매우 조밀하게 뭉쳐져 있는 것으로 확인되었다. Fig. 4는 SSA처리를 시간대별로 정리한 그림으로, 코어쉘(Core-shell) 구조를 주로 이루고 있으며, 코어 부분의 경우 Fig. 3에서 나타나 있듯이, 3.56 1 nm와 1.91 1/nm의 면간 거리를 가지며 이를 환산할 경우 2.81 Å와 5.22 Å이다. 이는 Zincite의 (100)면과 (001)면이다.
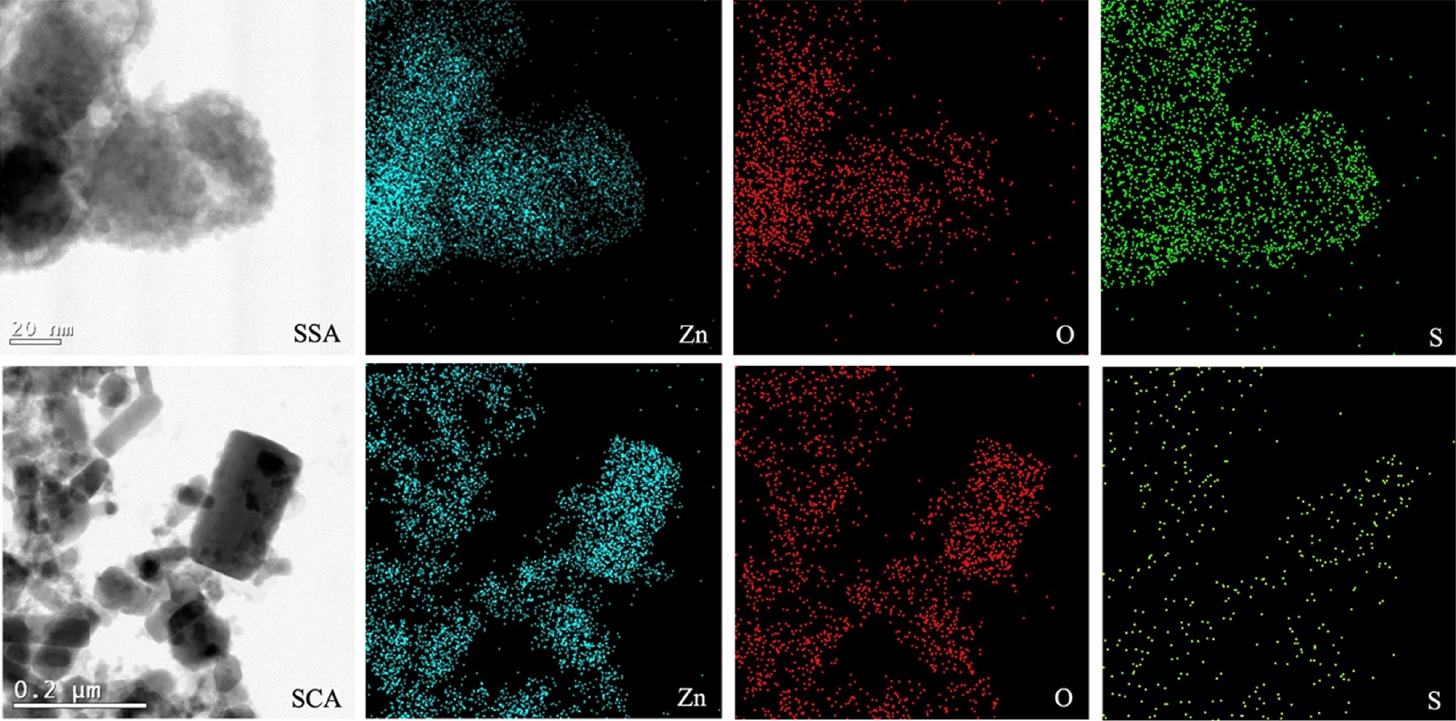
변환된 작은 ZnO NP를 SAED로 분석한 결과 3.211/nm의 d-spacing 값이 측정되었고, 이를 환산할 경우 3.11 Å로 계산된다. 48시간 경과된 후 TEM 이미지를 획득한 결과, Fig. 3에서 나타나 있듯이 ZnO의 코어 부분이 줄어드는 이 미지를 볼 수 있으며, 코어의 d-spacing는 3.56 1/nm이며, 이를 환산하면 2.81 Å이고, 이는 ZnO의 (100)면이다. 주변 ZnS의 FFT 이미지를 확인한 결과 3.21 1/nm의 d-spacing이며, 이를 환산할 경우 3.11 Å이며, 이는 Cubic 형태의 ZnS 결정체이며, Polycrystal 형태로 집적되어있다. 168시간 경과된 후 TEM 이미지를 획득한 결과, ZnO가 사라지면서 코어쉘구조는 사라지고, 10 nm 이하의 입자들이 뭉쳐서 하나의 큰 응집체를 이루고 있는 것으로 나타났다. TEM-EDS를 이용하여 원소 분포를 mapping하였으며, 그 결과를 Fig. 6에 도식화 하였다. 그림에서 확인 가능하듯이 SSA 처리에서는 Zn, O 그리고 S가 동시에 관찰되었으며, SCA 처리에서는 Zn와 O만 관찰되었는데, 이는 SSA 처리가 ZnO NP에서 ZnS NP 구조로 변환되는 과정임을 나타낸다. 이러한 구조들을 확실히 규명하기 위하여 XRD와 XPS 분석을 실시하였다.
3.4. 배치 실험에 따른 결정 구조 및 결합 구조 분석 결과
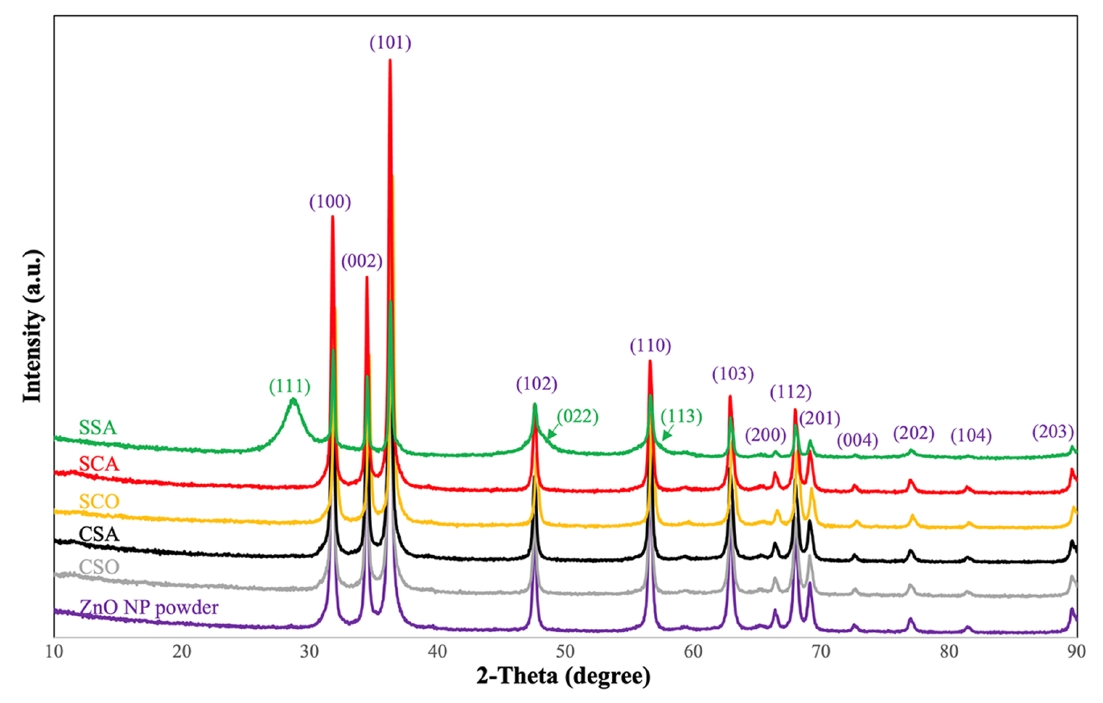
ZnO 나노입자를 168시간 실험 후 건조하여 파우더 형태로 XRD 분석을 실시하였다. Fig. 5는 처리군과 ZnO NP powder의 XRD의 회절패턴을 비교한 그림이며, 괄호 안의 숫자는 밀러익덱스를 나타낸다. 2-Theta에서 주 피크는 31.97°, 34.62°, 36.44°, 47.71°, 56.75°, 63.00°, 66.57°, 68.09°, 69.21°, 72.75°, 그리고 77.13°로 나타났으며, 이는 Zincite의 (100), (002), (101), (102), (110), (103), (200), (112), (201), (004), 그리고 (202)면으로 indexing되었다. 그림에서 보이지는 않지만 혐기성 조건과 호기성 조건을 비교하였을 때, 2-Theta가 증가하는 방향으로 Shifting 되었는데 이는 기존의 Al이 도핑된 구조에서 Al이 Zn 혹은 다른 물질로 치환되면서 면간 거리가 감소되는 것으로 추정할 수 있다. TEM 이미지 분석의 경우 측정에서 오차가 XRD 분석보다 크게 나타나기 때문에 차이가 없는 것으로 판단되었지만, XRD 분석은 그 차이를 나타내는 것으로 판단된다. XRD를 이용한 결정구조 평가의 경우 혐기성 조건과 혐기성-탄산염 풍부조건에서는 TEM 분석과 일치하게 Hexagonal 결정 구조를 가지는 ZnO NP로 나타났다. SSA에서는 Sphalerite가 Zincite와 함께 나타나는 것으로 확인되었다. 이는 TEM의 결과와 일치하게 ZnS와 ZnO가 공존하는 결과 때문이다. 그 결과 ZnO NP가 ZnS NP로 작게 변환되는 것을 확인할 수 있었다.
환경 조건 별로 처리된 ZnO 나노입자를 원심분리하여 건조시켜 펠렛 형태로 제조 한 뒤 XPS 분석을 실시하였고 그 결과를 Fig. 7에 나타내었다. XPS 분석 결과 SSA 처리군을 제외하고 나머지 처리군에서는 ZnO 결합의 Binding energy인 1021.5 eV와 일치하는 것으로 SSA에서는 1023.5 eV에서 피크가 관찰되었다. ZnO와 Zn-S 결합 모두 이전에 보고된 값인 1021.6 eV와 1023.3 eV 값과 유사한 것으로 판단된다[14]. XRD 구조 분석 결과 ZnO와 ZnS가 혼합되어 존재하는 상황으로 나타났는데, 혐기성-황화물 풍부조건에서 피크의 shift현상은 관측되었지만 피크가 넓어지는 현상은 관찰되지 않는 것은 다음과 같이 해석될 수 있다. XPS 분석의 경우 샘플 투과 깊 이가 약 5 nm 정도로 매우 얕은 표면에 대해서 분석이 수행되어 ZnO가 코어(Core)형태로 있고 ZnS가 쉘(Shell) 형태로 존재하기 때문에, 20 nm etching 이후에도 관측되지 않는 것으로 나타났다. Etching 결과 ZnS 결합이 증가하는 것으로 나타났고, 이는 측정과정에서 표면에 결합되어 있던 산소와 이산화탄소가 제거되면서 나타나는 결과로 추정된다.
4. 결 론
본 연구는 다양한 환경조건이 ZnO NP의 구조 변환에 미치는 영향을 다양한 결정 구조 측정 장비를 통해 분석함으로서 환경 내 변환을 통한 ZnO NP의 성상과 이동성을 예측하고자 하였다. 시간이 경과함에 따라 하수에 용해되어 있는 다양한 이온들은 ZnO NP의 표면에 electrostatic attraction에 의해 응집하는 것을 확인하였다. 각 처리군들의 입자의 크기는 pH와 전기 전도도가 증가함에 따라 감소되었는데, 이는 pH가 ZnO NP의 표면 전하의 입자간 반발력을 증가시킨 결과에 따른 것으로 보여진다. CSO와 CSA는 구형의 ZnS NP의 입도 분포를 나타내었으며, 탄산염이 처리된 SCO와 SCA는 직사각형의 형태로 커진 Hexagonal 결정인 것으로 확인되었다. SSA에서는 10 nm이하의 구형 입자들이 매우 조밀하게 뭉쳐져 있는 것으로 관찰되었는데, 이는 ZnO NP에서 ZnS NP구조로 변환되는 과정에서 나타내는 Sphalerite와 Zincite가 함께 공존하고 있는 결과로 확인되었다. 또한, SAA 처리에서 전기전도도 값의 증가는 ZnO NP가 Zn2+ 이온으로 해리되었다는 것을 시사한다. 이와 같이 다양한 환경조건에 노출된 ZnO NP의 구조 변환은 ZnO NP의 이동성을 증가시킴에 따라 다양한 환경 내 독성과 위해도를 증가시킬 우려가 있다. 따라서, 본 연구는 환경 변화에 따른 금속 산화 나노 입자의 구조 변환에 대한 지속적인 연구가 필요함을 시사하며, 궁극적으로 복합 환경 조건에서 금속 산화 나노 입자의 구조 변환과 이에 따른 독성과 위해도를 평가하고 거동을 예측하는 연구의 기초 자료로 활용될 것으로 기대한다.